
| A.氮 | B.氯 | C.溴 | D.碘 |
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源:不详 题型:单选题
| A.加明矾使海水中的盐分沉淀而淡化 |
| B.在一定条件下将海水缓慢过滤以获得淡水 |
| C.利用太阳能将海水蒸发淡化 |
| D.在一定条件下选择CCl4作萃取试剂,将海水萃取而淡化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

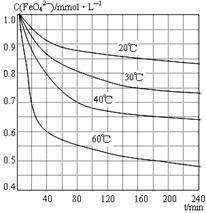
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
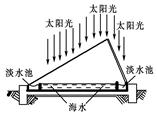
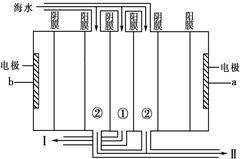
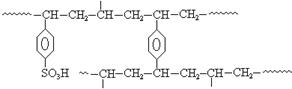
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
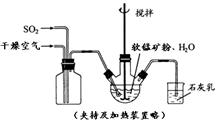
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
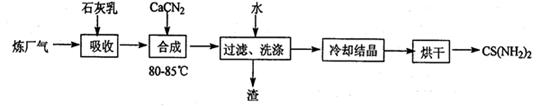
 2H2(g)+S2(g),其平衡常数表达式为K=。
2H2(g)+S2(g),其平衡常数表达式为K=。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.充分利用太阳能 |
| B.因地制宜开发利用风能、水能、地热能、潮汐能 |
| C.合理、安全开发利用氢能、核能 |
| D.能源都是通过化学反应获得的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.乙醇汽油是一种纯净物 |
| B.乙醇汽油作燃料不会产生碳氧化物等有害气体,其优点是可以减少对环境的污染 |
| C.乙醇和汽油都可作溶剂,也可相互溶解 |
| D.乙醇和乙二醇互为同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com