
| A. | 分散系中分散质粒子直径由小到大的正确顺序是:溶液<胶体<浊液 | |
| B. | 将纳米材料(微粒直径是1nm-100nm)分散到分散剂中得到的分散系有丁达尔效应 | |
| C. | 氢氧化铁胶体的制备方法是:将氢氧化铁固体溶于沸水中继续煮沸 | |
| D. | 胶体与其它分散系的本质区别是胶体的分散质粒子的微粒直径在1nm-100nm之间 |
分析 A.根据分散质微粒直径的大小,可以将分散系分为三类:溶液、胶体、浊液;
B.纳米材料(微粒直径是1nm-100nm)分散到分散剂中得到胶体;
C.用饱和氯化铁溶液制备氢氧化铁胶体;
D.胶体区别于其他分散系的本质特征是分散质微粒直径的大小不同.
解答 解:A.根据分散质微粒直径的大小,可以将分散系分为三类:溶液、胶体、浊液,用数轴表示为: ,则分散系中分散质粒子直径由小到大的正确顺序是:溶液<胶体<浊液,故A正确;
,则分散系中分散质粒子直径由小到大的正确顺序是:溶液<胶体<浊液,故A正确;
B.纳米材料(微粒直径是1nm-100nm)分散到分散剂中得到胶体,胶体能产生丁达尔效应,故B正确;
C.用饱和氯化铁溶液制备氢氧化铁胶体,将氢氧化铁固体溶于沸水中继续煮沸不能得到,氢氧化铁胶体,故C错误;
D.胶体区别于其他分散系的本质特征是分散质微粒直径的大小不同,分散质粒子的微粒直径在1nm-100nm之间的分散系属于胶体,故D正确.
故选C.
点评 本题考查了分散系的分类、胶体的性质,题目难度不大,学习中注意相关基础知识的积累,侧重于考查学生对基础知识的应用能力.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:解答题

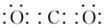 ,若在C池中生成64gCu,则整个装置中共生成H2SO42mol.
,若在C池中生成64gCu,则整个装置中共生成H2SO42mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 I2在KI溶液中存在平衡:I2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c($I_3^-$)与温度T的平衡曲线图如图.下列说法不正确的是( )
I2在KI溶液中存在平衡:I2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c($I_3^-$)与温度T的平衡曲线图如图.下列说法不正确的是( )| A. | 反应I2(aq)+I-(aq)?I3-(aq) 的△H>0 | |
| B. | 若温度为T1、T2,反应的平衡常数分别为 K1、K2,则K1>K2 | |
| C. | 若反应进行到状态D时,一定有v正>v逆 | |
| D. | 状态A与状态B相比,状态A的c (I2) 小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石和石墨互为同素异形体 | |
| B. | Na的还原性强于金刚石 | |
| C. | 46g Na完全反应需要标准状况下CO2的体积为33.6L | |
| D. | 当有0.4mo1 Na参与反应时,被还原的CO2的分子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
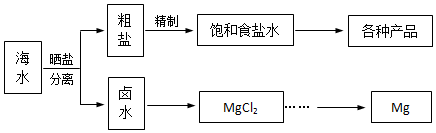
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和SO3互为同分异构体 | |
| B. | 二氧化碳和干冰互为同素异形体 | |
| C. | CH3CH2OH和 CH3-O-CH3 互为同分异构体 | |
| D. | 红磷和白磷互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物里3种物质反应时消耗盐酸的物质的量浓度之比为1:1:3 | |
| B. | 反应后所得溶液中的Fe2+离子与Cl-离子的物质的量浓度之比为1:1 | |
| C. | 混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多 | |
| D. | 混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com