
 近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )
近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过固体电解质向Cu极移动 | |
| B. | 若负载为铅蓄电池,则在对铅蓄电池充电时与Cu极相连的一极发生还原反应. | |
| C. | 通空气时时,正极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH- | |
| D. | 整个反应过程中,铜相当于催化剂. |
分析 放电时,锂失电子作负极,Cu得电子作正极,负极上电极反应式为Li-e-═Li+,正极上电极反应式为Cu2O+H2O+2e-=2Cu+2OH-,电解质溶液中阳离子向正极移动,阴离子向负极移动,据此分析解答;
解答 解:A.放电时,阳离子向正极移动,则Li+透过固体电解质向Cu极移动,故A正确;
B.因为Cu得电子作正极,所以若负载为铅蓄电池,则在对铅蓄电池充电时与Cu极相连的一极为阳极发生氧化反应,故B错误;
C.放电过程正极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH-,故C正确;
D.通空气时,铜被腐蚀,表面产生Cu2O,放电时Cu2O转化为Cu,则整个反应过程中,铜相当于催化剂,故D正确;
故选B.
点评 本题考查了原电池原理,明确原电池负极上得失电子及电极反应式是解本题关键,题目难度中等,注意把握Cu在整个过程中的作用.


科目:高中化学 来源: 题型:解答题
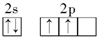 b.
b.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O | |
| B. | 磁性氧化铁溶于氢碘酸:Fe3O4+8HI=2Fe3++Fe2++4H2O+8I- | |
| C. | NaHSO4溶液中滴加过量的Ba(OH)2溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 醋与氨水混合:CH3COOH+NH3?H2O=CH3COONH4+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 草酸与氢氧化钠溶液混合呈中性时,溶液中存在:c(Na+)=c(HC2O4-)+c(C2O42-) | |
| B. | NaHC2O4与NaClO溶液混合,反应的离子方程式为:HC2O4-+ClO-=HClO+C2O42- | |
| C. | (NH4)2C2O4溶液中:c(NH4+)=2 c(H2C2O4)+2 c(HC2O4-)+2 c(C2O42-) | |
| D. | 草酸使酸性KMnO4溶液褪色,离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,K增大 | B. | K=K1+K2 | ||
| C. | 适当升温,可提高消毒效率 | D. | 压强增大,K2减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com