
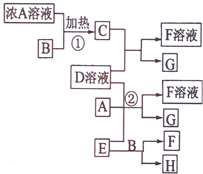
 有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质,且受热易升华.实验室中,常用固体E在B的催化下加热制取气体单质H,H能使带火星的木条复燃.
有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质,且受热易升华.实验室中,常用固体E在B的催化下加热制取气体单质H,H能使带火星的木条复燃.分析 G为紫黑色固体单质,且受热易升华,则G是碘单质;H能使带火星的木条复燃,则H是氧气;常用氯酸钾在二氧化锰的催化下加热分解制取氧气,所以E是氯酸钾,B是二氧化锰;二氧化锰与浓盐酸加热生成氯气,则C是氯气,所以A是浓盐酸,D是KI,F是KCl,KI、KClO3和HCl发生反应生成碘和KCl、水.
(1)反应①是二氧化锰与浓盐酸加热反应生成氯气、氯化锰、水;
(2)反应②是KI、KClO3和HCl发生反应生成碘和KCl、水;
(3)实验室制取氧气还可以用过氧化氢分解的方法;
(4)KI与Pb(NO3)2溶液反应生成沉淀为PbI2,若D的浓度为1.0×10-2mo1/L,则混合后c(I-)=1.0×10-2mo1/L/2=5×10-3mo1/L,根据Ksp计算铅离子浓度.
解答 解:G为紫黑色固体单质,且受热易升华,则G是碘单质;H能使带火星的木条复燃,则H是氧气;常用氯酸钾在二氧化锰的催化下加热分解制取氧气,所以E是氯酸钾,B是二氧化锰;二氧化锰与浓盐酸加热生成氯气,则C是氯气,所以A是浓盐酸,D是KI,F是KCl,KI、KClO3和HCl发生反应生成碘和KCl、水.
(1)反应①是二氧化锰与浓盐酸加热反应生成氯气、氯化锰、水,化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)反应②是KI、KClO3和HCl发生反应生成碘和KCl、水,离子方程式为:ClO3-+6I-+6H+═Cl-+3I2+3H2O,
故答案为:ClO3-+6I-+6H+═Cl-+3I2+3H2O;
(3)实验室制取氧气还可以用过氧化氢分解的方法,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(4)根据题意,沉淀必是PbI2,混合后,c(I-)═5×10-3mol/L,根据Ksp=c[Pb(NO3)2]•c2(I-),
则生成沉淀时,混合溶液中的Pb(NO3)2溶液的最小浓度为 $\frac{7.0×1{0}^{-9}}{(5×1{0}^{-3})^{2}}$=2.8×10-4mol/L,
混合前,即原Pb(NO3)2溶液的最小浓度为2×2.8×10-4mol/L=5.6×10-4mol/L.
故答案为:5.6×10-4.
点评 本题考查元素化合物的推断,题目难度中等,本题涉及氧化还原反应原理、溶度积等的计算具有一定的综合性,注意根据物质的特性作为该推断题的突破口.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$
 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$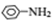 苯胺:弱碱性,易氧化
苯胺:弱碱性,易氧化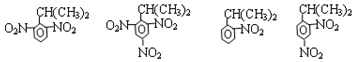 (写出一种的结构简式).
(写出一种的结构简式). .
.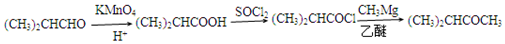 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑨ | ⑦ | ⑧ |
 .
.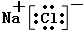
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中氯气既是氧化剂又是还原剂 | |
| B. | KCl既是氧化产物又是还原产物 | |
| C. | 该反应中的氧化剂只有KOH | |
| D. | 氧化产物与还原产物物质的量之比为5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 5H3AsO4+4Br2+4K2SO4+4H2O.
5H3AsO4+4Br2+4K2SO4+4H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=0的溶液中:Na+、K+、MnO4-、I- | |
| B. | 中性溶液中:K+、SO42-、Fe3+、Na+ | |
| C. | c(H+)/c(OH-)=10-3的溶液中:Na+、K+、CO32-、S2- | |
| D. | 水电离出的H+为10-12溶液:K+、NH4+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -44.2kJ•mol-1 | B. | +44.2kJ•mol-1 | C. | -330kJ•mol-1 | D. | +330kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com