
 如图是元素周期表的一部分.表中所列字母分别代表某一化学元素.
如图是元素周期表的一部分.表中所列字母分别代表某一化学元素.| 锂 | X | Y | |
| 失去一个电子 | 519 | 502 | 580 |
| 失去二个电子 | 7296 | 4570 | 1820 |
| 失去三个电子 | 11799 | 6920 | 2750 |
| 失去四个电子 | 9550 | 11600 |
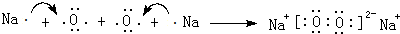 .
.分析 (1)根据元素所在周期表中的位置判断对应单质可能具有的性质;
(2)根据电离能的大小结合原子核外电子排布判断可能的元素种类,注意电离能的大小能判断出元素的化合价,即最外层电子数,
①Li原子失去1个电子后形成稳定结构,再失去1个电子很困难;
②由表中数据可知,X的第二电离能剧增,故X表现+1价,处于第ⅠA族,且第一电离能比Li的小,说明比锂的金属性强,应为周期表中的Na元素,j为O元素,二者形成的Na2O2属于离子化合物;
③由表中数据可知,Y的第四电离能剧增,故Y表现+3价,最外层电子数为3,应为ⅢA族元素;
④e 元素为Ti是22号元素,价电子排布式为3d24s2,处于最低能量的原子叫做基态原子,基态电子排布遵循能量最低原理、保里不相容原理和洪特规则,根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写.
解答 解:周期表分析可知a为Na、b为H、c为Mg、d为Sr、e为Ti、f为Al、g为Ge、h为C、i为P、j为O、k为Te、l为Cl、m为Ar,
(1)从所给元素在周期表中的位置不难知道,a、c、d、e、f、g分别为Na、Mg、Sr、Ti、Al、Ge,都是金属,它们都是电的良导体,h为碳元素,其单质中的一种石墨也是电的良导体,故应选④,
故答案为:④;
(2)①锂原子核外共有3个电子,其中两个在K层,1个在L层,当失去最外层的一个电子后,最外层电子排布为1S2,轨道全满,锂离子处于稳定结构,根据题给信息可知,要使锂离子再失去电子便会形成不稳定结构,因此锂原子失去第二个电子时所需能量远大于失去第一个电子所需的能量,
故答案为:锂原子失去一个电子后形成Li+,最外层电子排布为1S2,轨道全满,所以再失去一个电子需要的能量远大于第一电离能;
②由表中数据可知:X失去第2个电子所需能量远大于失去第一个电子所需的能量(9倍多),而失去第三个、第四个电子所需能量皆不足前者的两倍,故第一个电子为最外层的1个电子,而其他几个电子应处于内层.结合所给的周期表知,X应为a,即钠元素,j为O,以原子个数1比1形成的一种化合物为过氧化钠属于离子化合物,形成过程表示的电子式为: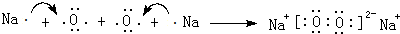 ,
,
故答案为: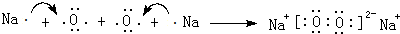 ;
;
③由表中所给Y的数据可知,Y失去第1、2、3个电子所需能量差别不大,而失去第4个电子所需能量远大于失去第3个电子所需的能量,因此Y元素的最外层有3个电子,即为ⅢA族的元素,
故答案为:ⅢA;
④e 元素为Ti,Ti元素为22号元素,原子核外有22个电子,所以核外电子排布式为:1s22s22p63s23p63d24s2,
故答案为:1s22s22p63s23p63d24s2.
点评 本题考查位置结构性质的相互关系及应用,题目难度中等,注意把握元素周期律的主要内容,注意电离能的大小与核外电子排布的关系.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 降低温度可以缩短反应达到平衡的时间 | |
| B. | 恒容时通入氩气,压强增大,平衡向右移动 | |
| C. | 恒容时通入X2,平衡向正反应方向移动,平衡常数不变 | |
| D. | 恒温恒压下,若混合气体密度不变,说明反应已达平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 互为同系物的有机物其组成元素相同,且结构必须相似 | |
| B. | 正戊烷分子中所有碳原子均在一条直线上 | |
| C. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 | |
| D. | 互为同系物的有机物其相对分子质量数值一定相差14 n(n为正整数) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,v(正)增大,v(逆)减小 | |
| B. | 增加C的量,反应速率增大,转化率增大 | |
| C. | 恒温恒压,再充入N2,平衡不发生移动 | |
| D. | 恒温恒容,再充入CO,最终逆反应速率增大,正反应速率也增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) | F | E |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的生成速率与NH3的分解速率相等 | |
| B. | 单位时间内生成nmolN2的同时生成3nmolH2 | |
| C. | N2、H2、NH3的浓度不再发生变化 | |
| D. | N2、H2、NH3的物质的量之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编 号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
| 0.1mol•L-1KI溶液 | 0.1mol•L-1H2O | X 0.1mol•L-1溶液 | 0.1mol•L-1双氧水 | 0.1mol•L-1稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 无 | t |
| 5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com