
【题目】按右下图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)( )

A. C1上发生还原反应
B. M 装置中SO42-移向Cu电极
C. 工作一段时间后装置M 中溶液pH变小,装置N中溶液pH变大
D. Cu电极与C2电极上的电极反应相同
科目:高中化学 来源: 题型:
【题目】下图是中学化学常用于混合物分离和提纯的装置,请根据装置回答问题:
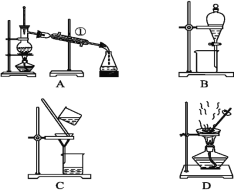
(1)从氯化钾溶液中得到氯化钾固体,选择装置____(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置_________。
(2)从碘水中分离出I2,选择装置____,该分离方法的名称为__________。
(3)装置B在分液时为使液体顺利下滴,应进行的具体操作是__________________________
(4)海水中蕴藏着丰富的资源,取少量海水按如下流程进行实验:
海水![]() 粗盐
粗盐![]() 食盐水
食盐水![]() 氯化钠晶体
氯化钠晶体
粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是____(填写字母序号)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦
c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,能使有毒气体转化为无毒气体:4CO(g)+2N02(g)![]() C02(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是_____填字母);
C02(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是_____填字母);
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C. 2v逆(NO2)=v正(N2)
D.容器内混合气体密度保持不变
(2)用活性炭还原法也可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g)△H。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g)△H。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
浓度/mol·L-1 | ||||||
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析Tl℃时,该反应在0~20 min的平均反应速率v(C02)=___;计算该反应的平衡常数K=____。(保留两位有效数字)
②根据上表数据判断,由30 min到40 min时改变的条件可能是(任写一种)_____。
(3)以CO2span>与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)=H2O(g)△H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式____。
(4)科学家利用原电池原理,在酸性溶液中将N02转化为HN03,则该转化的负极电极方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 节日里燃放的五彩缤纷的烟花是某些金属元素化学性质的展现
B. 将等物质的量的氧化钠和过氧化钠分别投入到足量且等质量的水中,得到溶质质量分数分别是 a%和 b%的两种溶液,则a 和 b 的关系是 a=b
C. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来, 说明金属铝的熔点较低
D. 用如图装置进行实验,将装置①中的 AlCl3 溶液滴入装置②浓氢氧化钠溶液,溶液中可观察到有大量白色沉淀产生

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 醋酸与氢氧化钠溶液反应:H++ OH-= H2O
B. 碳酸氢钠水解的离子方程式:HCO3-+ H2O ![]() H3O+ + CO32-
H3O+ + CO32-
C. 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
D. 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是
A. ρ=![]() B. w=
B. w=![]()
C. w=![]() D. c=
D. c=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 将100mL0.1molL-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
B. 常温常压下,4.6 g C2H6O所含碳氢共价键数为0.6 NA
C. 2gD216O中含有的质子数、中子数,电子数均为NA
D. 向FeI2溶液中通入适量Cl2,当有lmolFe2+被氧化时,共转移的电子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量的铝铁合金与100mL很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4 mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
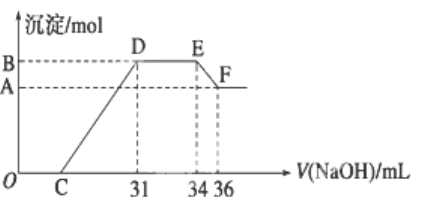
(1)结合OH-的能力最弱的是________(填离子符号)
(2)B与A的差值为________mol.
(3)原混合物中铝粉与铁粉的物质的量之比为______.
(4)B点对应的沉淀量为________mol,C点对应的溶液体积为________mL.
(5)硝酸溶液的物质的量浓度为_________mol·L-1
(6)写出铝与该浓度硝酸反应的离子方程式_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com