
【题目】某种化合物的结构如图所示,其中X、Y、Z、Q、W为原子序数依次增大的五种短周期元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的。下列叙述正确的是
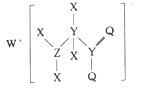
A.WX的水溶液呈中性
B.元素非金属性的顺序为Y>Z>Q
C.Z的最高价氧化物对应的水化物是一元强酸
D.该化合物中与Y单键相连的Q不满足8电子稳定结构
科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,其中每个数字编号代表一种短周期元素。
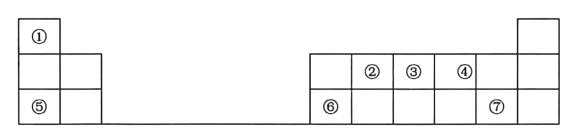
请按要求回答下列问题:
(1)元素②的元素名称是____。
(2)元素⑤处于周期表中第____周期第___族。
(3)①⑦七种元素中原子半径最大的是___(填元素符号)。②③④三种元素的最简单氢化物中最稳定的是____(填化学式)。
(4)元素③和元素⑦的氢化物均极易溶于水,且二者能反应产生大量白烟,写出该白色物质发生分解的化学方程式______。
(5)元素⑥的最高价氧化物对应的水化物是一种____性氢氧化物,该物质与元素⑦的最高价氧化物对应水化物反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
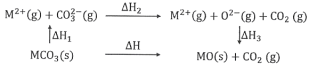
下列说法正确的是
A.△H1(CaCO3)>△H1(MgCO3)>0
B.△H2(MgCO3)>△H2(CaCO3)>0
C.△H1(CaCO3)-△H1(MgCO3)=△H3(CaO)-△H3(MgO)
D.对于MgCO3和CaCO3,△H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
B.向碳酸氢铵溶液中加入过量的NaOH溶液:NH4++OH-=NH3·H2O
C.向明矾溶液中加入Ba(OH) 2溶液至生成沉淀的物质的量最多:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
D.等体积、等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。
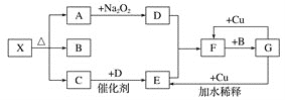
(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(![]() ),是一种高效消毒剂,它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下
),是一种高效消毒剂,它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下
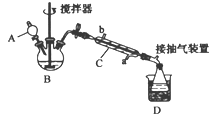
①在三颈烧瓶中加入一定量冰醋酸与浓硫酸的混合物,再缓缓加入适量30%的双氧水;
②不断搅拌并控制装置B中混合液的温度为20~30℃至反应结束;
③接入仪器C和抽气泵,在锥形瓶中收集得到产品。
回答下列问题:
(1)仪器C的名称是_______,仪器C中冷水流入口是_______ (填“a”或“b”)。
(2)为更好地控制反应温度,应采用的加热方法是______________。
(3)生成过氧乙酸的化学方程式为_________________。
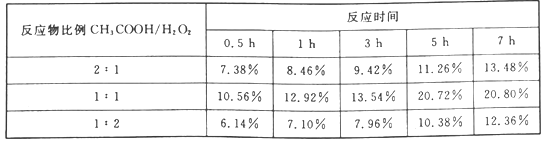
(4)实验测得产物过氧乙酸的百分含量随反应物比例和反应时间的变化数据如下表。由表中数据可知,反应物最佳比例(CH3COOH/H2O2)是_______,最佳反应时间约_______。
(5)产品中过氧乙酸浓度的测定:取2.00mL过氧乙酸产品试样,加水稀释成100mL;从中取出5.00mL,逐滴滴加酸性KMnO4溶液至溶液恰好呈粉红色,以除去残余的H2O2;再加入稍过量的KI溶液,发生反应CH3COOOH+2I-+2H+=I2+CH3COOH+H2O;反应完全后,滴入几滴淀粉溶液,用0.1000mol·L-1的Na2S2O3标准液滴定至终点(反应式为2S2O32-+I2=S4O62-+2I-),消耗14.30mLNa2S2O3标准液。则产品中过氧乙酸的物质的量浓度是________mol·L-1 (保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下均呈气态;Y的原子最外层电子数是其电子层数的2倍;M与X同族;Z、G分别是地壳中含量最高的非金属元素和金属元素。回答下列问题:
(1)Y、Z、M、G四种元素的原子半径由大到小的顺序是____________ (用元素符号表示)。
(2)Z在元素周期表中的位置为____________,M2Z的电子式为____________。
(3)上述元素的最高价氧化物对应的水化物中,酸性最强的水化物是__________(写化学式)。
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且它的产量可以用来衡量一个国家的石油化工发展水平的是____________ (写名称)。
(5)GQ3溶液与过量的MZX溶液反应的化学方程式为_________________________________
(6)常温下,不能与G的单质发生反应的是____________ (填标号)。
a.CuSO4溶液 b.浓硫酸 c.NaOH溶液 d.浓硝酸 e.氧化铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:
Cu2S+2Cu2O=6Cu+SO2↑,关于该反应的说法中正确的是
A.该反应的氧化剂与还原剂物质的量之比为2:1
B.Cu2S 在反应中只做还原剂
C.Cu 是氧化产物,SO2是还原产物
D.每生成38.4gCu,反应中转移0.6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是不同温度下水的离子积常数:
温度/℃ | 25 | T1 | T2 |
水的离子积常数 | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25℃<T1<T2,则a__________1×10-14(填“>”、“<”或“=”),做此判断的理由是______________________________________。
(2)25℃时,某Na2SO4溶液中c(SO42—)=5×10-4mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=__________。
(3)T2℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__________。此溶液中各种离子的浓度由大到小的顺序是____________________________。
(4)常温下,设某pH值的硫酸中水电离出的c(H+)=1.0×10-amol/L,设相同pH值的硫酸铝中水电离出的c(H+)=1.0×10-bmol/L,(a、b都是小于14的正数),那么a、b之间满足的关系式是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com