
【题目】下表是元素周期表的一部分,根据所给的10 种元素,回答下列间题.
族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | C | N | F | Na | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)非金属性最强的元素是;
(2)Ne 原子结构示意图为;
(3)C 与N 中,原子半径较小的是;
(4)氯水具有漂白作用,是由于其中含有(填“HCl”或“HClO”)
(5)元素最高价氧化物对应的水化物中,碱性最强的是(填化学式),呈两性的是(填化学式);
(6)元素硅的氧化物常用于制造(填一种高性能的现代通讯材料的名称);
(7)如图为某有机物的球棍模型(其中 ![]() 代表氢原子代表
代表氢原子代表 ![]() 碳原子),
碳原子), 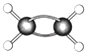 该有机物中碳元素与氢元素的质量比m(C):m(H)= . (相对原子质量C﹣12、H﹣1)
该有机物中碳元素与氢元素的质量比m(C):m(H)= . (相对原子质量C﹣12、H﹣1)
(8)镁是制造汽车、飞机、火箭的重要材料.写出工业上电解熔融氯化镁获得金属镁的化学方程式 .
【答案】
(1)F
(2)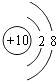
(3)N
(4)HClO
(5)NaOH;Al(OH)3
(6)光导纤维
(7)6:1
(8)MgCl2 ![]() Mg+Cl2↑
Mg+Cl2↑
【解析】解:(1)根据元素周期律知,位于元素周期表右上角的元素非金属性最强,所以这几种元素中,非金属性最强的是F元素,所以答案是:F;(2)Ne原子核外有10电子,其原子结构示意图为: 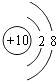 ,所以答案是:
,所以答案是: 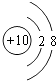 ;(3)同一周期中,元素的原子半径随着原子序数的增大而减小,所以N元素的原子半径较小,所以答案是:N;(4)氯水具有漂白性是因为氯水中含有次氯酸,所以答案是:HClO;(5)元素的金属性越强其最高价氧化物的水化物碱性越强,这几种元素中金属性最强的是Na元素,所以碱性最强的是NaOH,Al(OH)3呈两性,所以答案是:NaOH;Al(OH)3;(6)二氧化硅常用于制造光导纤维,所以答案是:光导纤维;(7)根据其球棍模型知,该物质是C2H4 , 乙烯中m(C):m(H)=(12×2):(1×4)=6:1,所以答案是:6:1;(8)镁是活泼金属,工业上采用电解熔融氯化镁的方法冶炼镁,电解反应方程式为MgCl2
;(3)同一周期中,元素的原子半径随着原子序数的增大而减小,所以N元素的原子半径较小,所以答案是:N;(4)氯水具有漂白性是因为氯水中含有次氯酸,所以答案是:HClO;(5)元素的金属性越强其最高价氧化物的水化物碱性越强,这几种元素中金属性最强的是Na元素,所以碱性最强的是NaOH,Al(OH)3呈两性,所以答案是:NaOH;Al(OH)3;(6)二氧化硅常用于制造光导纤维,所以答案是:光导纤维;(7)根据其球棍模型知,该物质是C2H4 , 乙烯中m(C):m(H)=(12×2):(1×4)=6:1,所以答案是:6:1;(8)镁是活泼金属,工业上采用电解熔融氯化镁的方法冶炼镁,电解反应方程式为MgCl2 ![]() Mg+Cl2↑,所以答案是:MgCl2
Mg+Cl2↑,所以答案是:MgCl2 ![]() Mg+Cl2↑.
Mg+Cl2↑.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】下列解释事实的化学方程式或离子方程式正确的是
A. 用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3===Ca2++2CH3COO-+CO2↑+H2O
B. NaOH溶液中通入Cl2 :2Cl2 + 2OH- = 3Cl- + ClO- + H2O
C. 稀硫酸中加入铁粉 2Fe+6H+===2Fe3++3H2↑
D. Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO+2OH-===CaCO3↓+CO![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见物质A~K之间存在如下图所示的转化关系,其中D、E为单质,请回答下列问题(图中有些反应的产物和反应的条件没有全部标出)。
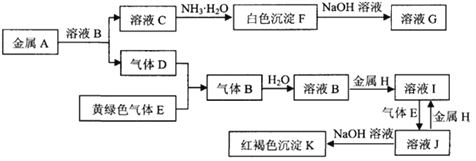
(1)写出下列物质中溶质的名称:B是 __________,G是____________
(2)反应“F→G”的化学方程式是_____________________________________________
(3)反应“J→I”的离子方程式是_____________________________________________
(4)溶液I中混有溶液J,除去J的方法是:________________________________________________________________
(5)检验溶液I中阳离子的方法是:__________________________
【答案】 氯化氢 偏铝酸钠 Al(OH)3+NaOH=NaAlO2+2H2O 2Fe3++Fe=3Fe2+ 加入足量的铁粉(过滤) 取少量溶液I于试管中,滴加几滴硫氰化钾溶液,溶液不变红色,再加几滴氯水,溶液变为红色,证明溶液中含有Fe2+。
【解析】C中加氨水生成白色沉淀F,F可溶于NaOH溶液中,可知F为Al(OH )3,则C中含有Al3+,从而A为Al。E为Cl2,D为气体且与Cl2反应生成另一种气体B,可推测B为HCl。验证可知B确为HCl。由红褐色沉淀K可知K为Fe(OH)3,所以H为Fe。
(1)由上面分析可知B是氯化氢、F为Al(OH )3,与NaOH反应生成Na2AlO2,G的名称为偏铝酸钠。
(2)Al(OH )3与NaOH反应生成Na2AlO2和H2O,化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O。
(3)金属H为Fe,B为HCl,所以I为FeCl2,J为 FeCl3,J→I的离子方程式为:2Fe3++Fe=3Fe2+。
(4)FeCl2溶液中混有FeCl3,可加入足量的Fe粉使Fe3+转化为Fe2+,然后过滤。
(5)检验FeCl2中Fe2+的方法:取少量溶液I于试管中,滴加几滴硫氰化钾溶液,溶液不变红色,再加几滴氯水,溶液变为红色,证明溶液中含有Fe2+。
【题型】推断题
【结束】
23
【题目】下图转化关系中,A、B、C、D、E都是短周期元素的单质,在常温常压下A是固体,其余都是气体,且C呈黄绿色。化台物H和I两种气体相遇时产生白烟。化合物G的焰色反应为黄色。反应①和②均在溶液中进行。
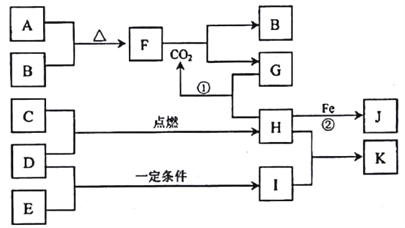
请按要求回答下列问题。
(l)写出下列物质的化学式:D________、F_______________。
(2)反应①的离子方程式为_____________。
(3)向K溶液中加入硝酸酸化的硝酸银溶液,反应的现象为__________。
(4)将少量单质C通入盛有淀粉KI溶液的试管中,液体变为蓝色,该反应的离子方程式为_________。这说明单质C的氧化性_______于单质碘(填“强”或“弱”)。
(5)向J溶液中滴入NaOH溶液时,生成的灰白色沉淀迅速变成灰绿色,最后变成红褐色。写出沉淀由灰白色变成红褐色的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Se是人体必需微量元素,下列有关 ![]() Se和
Se和 ![]() Se的说法正确的是( )
Se的说法正确的是( )
A.![]() ?Se 和
?Se 和 ![]() Se所含电子数不同
Se所含电子数不同
B.![]() Se和
Se和 ![]() Se都含有34个中子
Se都含有34个中子
C.![]() Se和
Se和 ![]() Se分别含有44和46个质
Se分别含有44和46个质
D.![]() Se和
Se和 ![]() Se互为同位素
Se互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往含有少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生如图变化,四条曲线(c和d图像部分重叠)溶液中离子的对应关系,正确的是
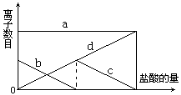
A.a:Cl- b:K+ c:CO32- d:HCO3-
B.a:K+ b:CO32- c:Cl- d:HCO3-
C.a:K+ b:CO32- c:HCO3- d:Cl-
D.a:K+ b:HCO3- c:Cl- d:CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水硫酸铜是一种重要的化学试剂,工业上用低品位钢矿(合CuS、Cu2S、CuO,以及FeO、Fe2O3、SiO2等杂质)制备无水硫酸铜的流程如下图所示:
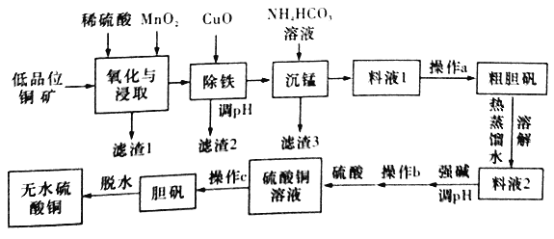
(NH4)2SO4、CuSO4的溶解度(g)部分数据如下表所示:
温度 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
S(CuSO4)/g | 17 | 20.7 | 24.4 | 28.5 | 33.6 | 40 | 77 |
S[(NH4)SO4]/g | 73 | 75.4 | 78.1 | 81.0 | 84.5 | 87.8 | 102 |
(1)氧化与浸取过程中发生的反应之一为Cu2S被MnO2氧化时有一种非全属单质生成,则该反应的离子方程式为____________,滤渣1的主要成分是__________(填化学式),除铁时加入CuO能得到滤渣2的原理是__________________。
(2)除铁后,为了判断滤液中是否有Fe3+残留,请设计实验方案:__________。
(3)沉锰时还有一种酸性气体生成,则沉锰时发生反应的离子方程式为___________。(已知pH=8.8时,Mn2+开始沉淀)。
(4)为了从料液1中尽可能多地析出粗胆矾,操作a的内容是__________(填名称)。
(5)工业上利用上述原理制备胆矾。已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=8.0×10-38。离子浓度小于1×10-5mol/L时表明该离子已完全沉淀。常温下,若某溶液中c(Cu2+)=2.2 mol/L,c(Fe3+)=O.001mol/L,加入氧化铜除铁时,调节溶液pH范围为________(lg5=0.7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A. 用氯化铁溶液腐蚀铜板:Cu+Fe3+=Cu2++Fe2+
B. Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-![]() =9Fe3++NO↑+14H2O
=9Fe3++NO↑+14H2O
C. 用小苏打治疗胃酸过多:NaHCO3+H+=Na++CO2↑+H2O
D. 往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大:Al3+ + 2SO42- + 2Ba2+ + 4OH-== AlO2-+ 2BaSO4↓+ 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com