
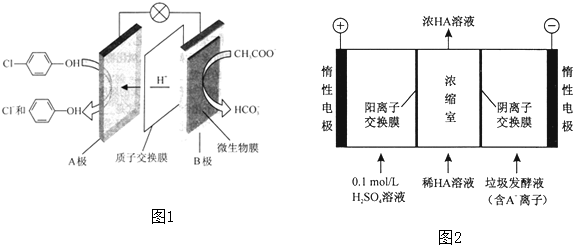
 )的废水可以通过构成微生物电池除去,其原理如图1所示.
)的废水可以通过构成微生物电池除去,其原理如图1所示. -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-,故答案为:Cl-
-OH+Cl-,故答案为:Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-;
-OH+Cl-;| 1 |
| 2 |
| 145g?L-1-10g?L-1 |
| 90g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 A、B、C是短周期里的3种元素的单质,甲、乙是常见的化合物,它们之间存在如图所示的转化关系:若A为有色气体,C 为无色气体,B为淡黄色固体,请回答:
A、B、C是短周期里的3种元素的单质,甲、乙是常见的化合物,它们之间存在如图所示的转化关系:若A为有色气体,C 为无色气体,B为淡黄色固体,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
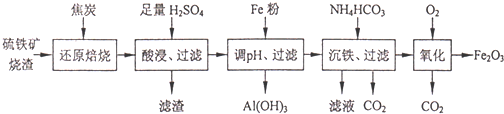
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
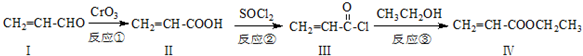
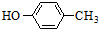 也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
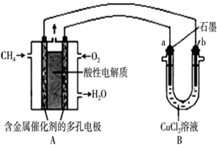 如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:
如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com