
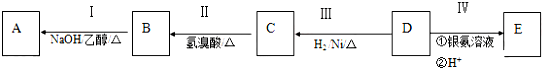
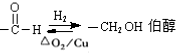

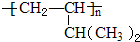
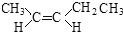
分析 有机物A为烃类化合物,其相对分子质量为70,分子中C原子最大数目为$\frac{70}{12}$=5…10,故A的分子式为C5H10.由转化关系可知D属于醛、E为羧酸、C为C属于醇、B为溴代烃、A为烯烃,其中B、D、E的结构中均含有2个-CH3,且它们均含有4种等效H,则D为(CH3)2CHCH2CHO,E为(CH3)2CHCH2COOH,C为(CH3)2CHCH2CH2OH,B为(CH3)2CHCH2CH2Br,A为(CH3)2CHCH=CH2.
解答 解:有机物A为烃类化合物,其相对分子质量为70,分子中C原子最大数目为$\frac{70}{12}$=5…10,故A的分子式为C5H10.由转化关系可知D属于醛、E为羧酸、C为C属于醇、B为溴代烃、A为烯烃,其中B、D、E的结构中均含有2个-CH3,且它们均含有4种等效H,则D为(CH3)2CHCH2CHO,E为(CH3)2CHCH2COOH,C为(CH3)2CHCH2CH2OH,B为(CH3)2CHCH2CH2Br,A为(CH3)2CHCH=CH2.
(1)B为(CH3)2CHCH2CH2Br,B中所含官能团的名称为溴原子,
故答案为:溴原子;
(2)Ⅱ为C中-OH被溴原子取代深生成B,属于取代反应,Ⅲ为醛基与氢气发生加成反应生成B,也属于还原反应,
故答案为:a、b;
(3)a.反应Ⅰ的化学方程式为:(CH3) 2CHCH2CH2Br+NaOH$→_{△}^{醇}$ (CH3)2 CHCH=CH2+NaBr+H2O,
b.A 在催化剂条件下,反应生成高聚物,反应方程式为:n CH(CH3)2CH=CH2$\stackrel{催化剂}{→}$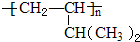 ,
,
故答案为:(CH3) 2CHCH2CH2Br+NaOH$→_{△}^{醇}$ (CH3)2 CHCH=CH2+NaBr+H2O;n CH(CH3)2CH=CH2$\stackrel{催化剂}{→}$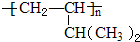 ;
;
(4)A为(CH3)2CHCH=CH2,A 的系统命名为3-甲基-1-丁烯,A 的同分异构体中有一对互为顺反异构的链状有机物,且结构中含有2个-CH3,其顺式异构体的结构简式为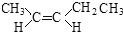 ,
,
故答案为:3-甲基-1-丁烯;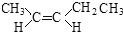 ;
;
(5)C为(CH3)2CHCH2CH2OH,C的某同分异构体F可以催化氧化,但不能发生消去反应,F的结构简式为(CH3)3CCH2OH,
故答案为:(CH3)3CCH2OH.
点评 本题考查有机物推断,涉及卤代烃、醇、醛、羧酸的性质与转化,计算确定A的分子式是关键,注意掌握掌握官能团的性质与转化,难度中等.


科目:高中化学 来源: 题型:解答题
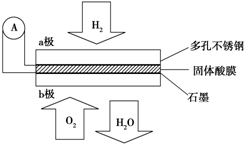
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
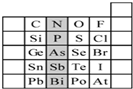 元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.请用元素符号或化学式填空:
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.请用元素符号或化学式填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.117 | 0.074 | 0.110 | 0.071 | 0.075 | 0.077 | 0.099 |
| 最高化合价 | +6 | +4 | +5 | +5 | +4 | +7 | ||
| 最低化合价 | -2 | -4 | -2 | -3 | -1 | -3 | -4 | -1 |
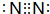 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
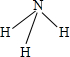 ,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为
,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为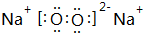 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑥ | B. | ②④⑥ | C. | 仅有⑥ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、D、E、F是原子序数依次增大的五种前四周期元素,相关信息如下:
A、B、D、E、F是原子序数依次增大的五种前四周期元素,相关信息如下:| A | 原子半径最小的元素 |
| B | 原子核外电子有6种不同的运动状态 |
| E | 原子L电子层上有两个未成对电子 |
| F | 原子最外层有2个电子,次外层电子数为D原子最外层电子数的2倍 |
 ,能量最高的电子占据的能级符号为3d,该能级所在能层具有的原子轨道数为9.
,能量最高的电子占据的能级符号为3d,该能级所在能层具有的原子轨道数为9.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 名称或俗名 | 主要用途 |
| K2FeO4 | 高铁酸钾 | 高能材料、水处理剂和氧化剂 |
| H2C2O4 | 草酸 | 重要还原剂、菠菜成分之一 |
| KAl(SO4)2•12H2O | 明矾 | 净水剂、用于制油条和糕点 |
| Cu2O | 氧化亚铜 | 用于制红色涂料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com