
科目:高中化学 来源: 题型:
| A、NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O |
| B、碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+2OH-=CO32-+NH3?H2O+H2O |
| C、用食醋和淀粉-KI试纸检验碘盐中的KIO3:IO3-+5I-+6H+=I2+3H2O |
| D、用惰性电极电解熔融氯化钠:2Cl-+2H2O=Cl2↑+H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样.为了确定该固体的成分,可以选择下列
(1)实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样.为了确定该固体的成分,可以选择下列查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.012 kg12C含有6.02×1023个碳原子 |
| B、1 mol任何物质都含有6.02×1023个原子 |
| C、硫酸的摩尔质量是98 g |
| D、常温常压下,1 mol氧气的体积为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、110g |
| B、110g/mol |
| C、55g/mol |
| D、55 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 |
| A | 水煤气 | 大理石 | 苛性钠 | 醋酸 | 二氧化碳 |
| B | 胆矾 | 空气 | 硫酸钠 | 一水合氨 | 石墨 |
| C | 生石灰 | 水煤气 | 盐酸 | 碳酸 | 铜 |
| D | 烧碱 | 汽油 | 硫酸钡 | 水 | 乙醇 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
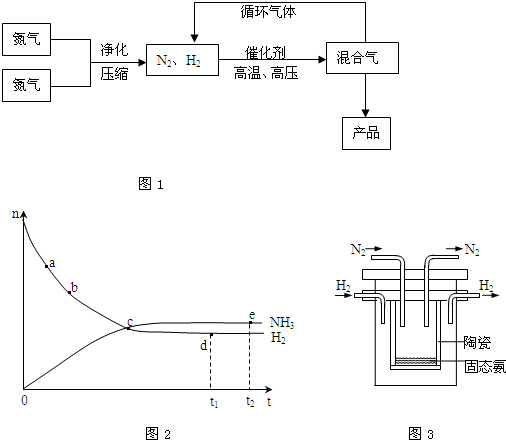
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com