
【题目】在一密闭容器中,反应mM(气) ![]() nN(气)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,M的浓度为原来的80%,则( )
nN(气)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,M的浓度为原来的80%,则( )
A.平衡逆向移动B.物质M的转化率增大C.n > mD.物质N的质量分数增加
【答案】A
【解析】
先假设体积增加一倍时若平衡未移动,M的浓度应为原来的50%,实际平衡时M的浓度是原来的80%,比假设大,说明平衡向生成M的方向移动,则m>n,据此结合选项判断。
先假设体积增加一倍时若平衡未移动,M的浓度应为原来的50%,实际平衡时M的浓度是原来的80%,比假设大,说明平衡向生成M的方向移动,则m>n;
A.假设体积增加一倍时若平衡未移动,M的浓度应为原来的50%,实际平衡时M的浓度是原来的80%,比假设大,说明平衡向生成M的方向移动,即向逆反应方向移动,故A正确;
B.减小压强,平衡向逆反应方向移动,M的转化率减小,故B错误;
C.减小压强,平衡向生成M的方向移动,则m>n,故C错误;
D.减小压强,平衡向逆反应方向移动,N的质量减小,混合气体的总质量不变,故物质N的质量分数减小,故D错误;
故答案选A。


科目:高中化学 来源: 题型:
【题目】硝酸汞和碘化钾溶液混合后会生成红色的碘化汞沉淀,为了探究硝酸汞和碘化钾溶液之间能否发生氧化还原反应,研究人员设计了如图的实验装置,结果电流计指针发生了偏转,下列分析正确的是( )
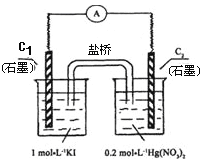
A.如图装置的电流方向是从C1到C2
B.C1是负极,发生的反应是2I-=I2+2e-
C.K+离子向C1电极流动
D.装置发生的总反应是Hg2++2I-=HgI2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可以从牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍 | 试通过计算填空: (1)A的相对分子质量为__。 |
将9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | (2)A的分子式为__。 |
另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团__、__。 |
A的核磁共振氢谱如图:
| (4)A中含有__种氢原子。 综上所述,A的结构简式为__。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普罗帕酮,为广谱高效膜抑制性抗心律失常药。具有膜稳定作用及竞争性β受体阻滞作用。能降低心肌兴奋性,延长动作电位时程及有效不应期,延长传导。化合物I是合成普罗帕酮的前驱体,其合成路线如图:
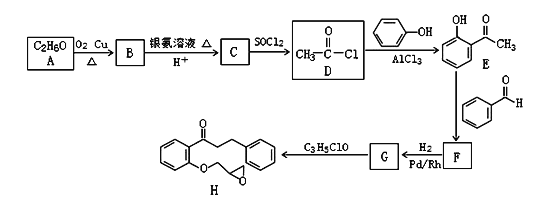
已知:CH3COCH3+CH3CHO![]() CH3COCH=CHCH3+H2O
CH3COCH=CHCH3+H2O
回答下列问题:
(1)H的分子式为_____________;化合物E中含有的官能团名称是_________。
(2)G生成H的反应类型是______。
(3)F的结构简式为_____。
(4)B与银氨溶液反应的化学方程式为__________。
(5)芳香族化合物M与E互为同分异构体,M中除苯环外,不含其他环状结构,且1molM能与2molNaOH反应,则M的结构共有___种,其中能发生银镜反应且核磁共振氢谱上显示4组峰的M的结构简式为:_______ 。
(6)参照上述合成路线,以2-丙醇和苯甲醛为原料(无机试剂任选),设计制备![]() 的合成路线:____。
的合成路线:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。(请用化学用语答题)
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1)R的元素符号为___,M在元素周期表中的位置为___。
(2)X与Y按原子个数比1∶1构成的物质的电子式为___,所含化学键类型___。
(3)X+、Y2-、M2-离子半径大小顺序为___。
(4)将YM2通入FeCl3溶液中的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在AgCl饱和溶液中尚有AgCl固体存在,当向溶液中加入0.1 mol/L的盐酸时,下列说法正确的是( )
A.AgCl沉淀溶解平衡向溶解方向移动B.AgCl的Ksp增大
C.溶液中c(Cl-)增大D.溶液中c(Ag+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2![]() H+ + HO2-,Ka=2.4×10-12)。下列说法错误的是
H+ + HO2-,Ka=2.4×10-12)。下列说法错误的是
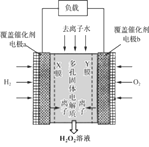
A.a极的电势低于b极
B.Y膜为选择性阴离子交换膜
C.每转移0.4 mol e-,就有0.1 mol H2O2生成
D.b极的电极反应为O2 + 2e- + H2O = HO2- + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是重要的催化剂和化工原料,工业上制备Cu2O的主要反应如下:
①C(s)+CO2(g)2CO(g) ΔH=+172.5 kJ·mol-1
②CO(g)+2CuO(s) Cu2O(s)+CO2(g) ΔH=-138.0 kJ·mol-1
(1)C与CuO反应生成Cu2O和CO的热化学方程式为_______。
(2)一定温度下,向5L恒容密闭容器中加入1molCO和2 molCuO,发生反应②,5 min时达到平衡,测得容器中CuO的物质的量为0.8mol。
①0~5 min内,用CO2表示的反应速率v(CO2)=____。
②CO的平衡转化率α=_______。
(3)向5L密闭容器中加入1molC和1molCO2,发生反应①,CO2、CO的平衡体积分数(φ)与温度(T)的关系如图所示:
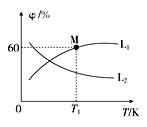
①能表示CO2的平衡体积分数与温度关系的曲线为____(填“L1”或“L2”),理由为_______。
②温度为T1时,该反应的平衡常数K=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新技术的开发应用,不仅有利于改善环境质量,而且能充分开发“废物”的潜在价值。
回答下列问题:
(1)用烟道气与氢气来合成甲醇涉及到如下几个反应:
①CO(g)+2H2(g)=CH3OH(g) △H=-91kJ·mol-1
②2CO2(g)=2CO(g)+O2(g) △H=+566kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
④CO2(g)+3H2(g)=CH3OH(g)+H2O(g)H=__kJ·mol-1。
(2)在容积均为2L的两个恒容密闭容器中发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g),有关数据如下:
CO2(g)+H2(g),有关数据如下:

①800°C时该反应的平衡常数K=__。
②容器2中x=__,n=___。
③若800℃起始时,在2L恒容密闭容器中加入CO、H2O、CO2、H2各1mol,则此时v正__v逆(填“>”“<”或“=”)。
(3)反应(NH4)2CO3+H2O+CO2![]() 2NH4HCO3OH可用于捕捉空气中的CO2,为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测定CO2气体的浓度,得到的曲线图如图:
2NH4HCO3OH可用于捕捉空气中的CO2,为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测定CO2气体的浓度,得到的曲线图如图:
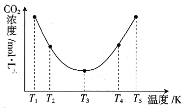
①H__0(填“>”“<”或“=”)。T1~T2区间,c(CO2)变化的原因是___。
②已知常温下NH3·H2O的电离常数K=1.8×10-5,碳酸的电离常数K1=4.4×10-7、K2=4.7×10-11,则恰好完全反应时所得的NH4HCO3溶液中c(H+)__c(OH-)(填“>”“<”或“=”)。
③在图中所示五种温度下,该反应的平衡常数最大的温度是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com