
分析 根据热化学方程式aH2(g)+aCO(g)?bCH3OCH3(g)+bCO2(g)△H=-246.4kJ•mol-1中的碳原子守恒可知a=3b,故热化学方程式又可以表示为:3吧H2(g)+3bCO(g)?bCH3OCH3(g)+bCO2(g)△H=-246.4kJ•mol-1,即3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-$\frac{246.4}{b}$kJ•mol-1.
然后根据盖斯定律,将所给的反应①②③通过变形得到反应3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H也做相应的变化,即可求出a和b的值.
解答 解:根据热化学方程式aH2(g)+aCO(g)?bCH3OCH3(g)+bCO2(g)△H=-246.4kJ•mol-1中的碳原子守恒可知a=3b,故热化学方程式又可以表示为:3吧H2(g)+3bCO(g)?bCH3OCH3(g)+bCO2(g)△H=-246.4kJ•mol-1,即3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-$\frac{246.4}{b}$kJ•mol-1.
根据盖斯定律可知:反应2×①+②+③即可得:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-246.4kJ•mol-1,
故有:246.4kJ•mol-1=$\frac{246.4}{b}$kJ•mol-1,解得b=1.
又由于a=3b,故a=3.
故答案为:3;1.
点评 本题考查了热化学方程式中的计量数的求算,虽然仍是考查了盖斯定律,但出题的角度很新颖,是一道好题.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
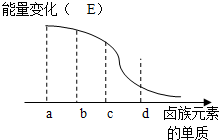 A、B、C、D为按顺序排列的前四种卤素单质,仔细分析下表中的数据,回答有关问题.
A、B、C、D为按顺序排列的前四种卤素单质,仔细分析下表中的数据,回答有关问题.| 卤素单质 | 密度(标准状况下) | 沸点/℃ | 熔点/℃ | 溶解度(标准状况下,100g水中) |
| A | 1.696 g•l-1 | -188.1 | -219.6 | -- |
| B | 3.214 g•l-1 | -34.6 | -101 | 226 cm3 |
| C | 3.119 g•cm-3 | 58.78 | -7.2 | 4.16 g |
| D | 4.93 g•cm-3 | 184.4 | 113.5 | 0.029 g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )| A. | 液滴中的Cl-由a区向b区迁移 | |
| B. | 液滴中心是正极区,发生的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成 Fe(OH)2,进一步氧化、脱水形成铁锈 | |
| D. | 若改用嵌有一铜螺丝钉铁板,在铜铁接触处滴加NaCl溶液,则负极:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3++e-═Fe2+ | B. | 2H++3e-═H2+ | C. | Fe2++2e-═Fe | D. | Cu2++2e-═Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 垃圾分类并回收利用,符合可持续发展的要求,是垃圾处理的发展方向 | |
| B. | 人类活动排入大气的氟氯代烷和含溴的卤代烃能使臭氧层受到破坏 | |
| C. | 防止水体污染和改善水质最根本的措施是控制工业废水和生活污水的排放 | |
| D. | 目前常用的垃圾处理方法有卫生填埋、堆肥和焚烧,这些方法对环境无污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g | B. | 33 g | C. | 33 g•molˉ1 | D. | 32 g•molˉ1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 3NO2+H2O═NO+2HNO3 | ||
| C. | CO+H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2+H2 | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com