
【题目】在烷烃分子中,每增加一个碳原子,每摩尔该烷烃完全燃烧需要多消耗氧气( )
A. 1 mol B. 1.5 mol C. 2 mol D. 2.5 mol
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
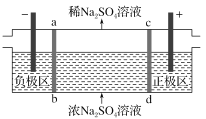
A. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极区的电极反应为2H2O-4e-==O2+4H+,负极区溶液pH降低
D. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在工农业上有重要作用。
Ⅰ、在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___________。该反应为__________(填“吸热”或“放热”)反应。
(2)某温度下平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),该温度下加入1 mol CO2(g)和1 mol H2(g),充分反应,达到平衡时,CO2的转化率为______________。
(3)在800 ℃时发生上述反应,某时刻测得容器内各物质的浓度分别为c(CO2)为2 mol/L,c(H2)为1.5 mol/L,c(CO)为1 mol/L,c(H2O)为3 mol/L,则正、逆反应速率的比较为:v正___________v逆(填“>”“<”或“=”)。
Ⅱ、工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJmol-1
CH3OCH3(g)+H2O(g)═2CH3OH(g)△H2=+23.4kJmol-1
则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H3=_______________kJ·mol-1。
CH3OCH3(g)+3H2O(g)△H3=_______________kJ·mol-1。
Ⅲ、常温下用氨水吸收CO2可得到NH4HCO3溶液,在该溶液中,c(NH4+)________(填“>”、“<”或“=”)c(HCO3—);反应NH4++HCO3—+H2O![]() NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2
NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
有机物A是聚合反应生产胶黏剂基料的单体,亦可作为合成调香剂I、聚酯材料J的原料,相关合成路线如下:
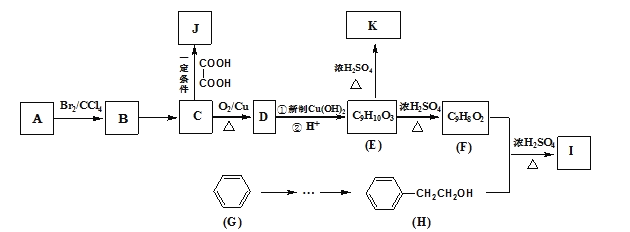
已知:在质谱图中烃A的最大质荷比为118,E的结构简式为: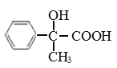
根据以上信息回答下列问题:
(1) A的分子式为___________,A所含的官能团名称为____________,E→F的反应类型为___________。
(2) I的结构简式为__________________________,
(3) D与新制氢氧化铜悬浊液反应的化学方程式为________________________________。
(4) H的同分异构体W能与浓溴水反应产生白色沉淀,1 mol W参与反应最多消耗3 mol Br2,请写出所有符合条件的W的结构简式_____________________________________。
(5) J是一种高分子化合物,则由C生成J的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
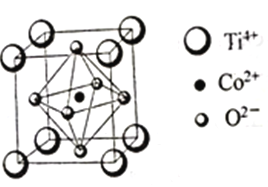
【题目】钴的化合物在磁性材料生产、电池制造、催化剂制备等方面应用非常广泛。
(1)Co2+基态核外电子排布式为_________。
(2)制备[Co(H2O)6]2+反应为(NH4)2[Co(SCN)4] +6H2O= [Co(H2O)6(SCN)2+2NH4SCN。
①配合物[Co(H2O)6]2+中与Co2+形成配位键的原子是________(填元素符号);SCN-的空间构型为________(用文字描述)。
②NH4SCN在180-190℃分解并制得胍(结构简式如图所示),胍分子中氮原子杂化轨道类型为_________; 1mol 胍中含σ键数目为________。

(3)一种钴的化合物可用作石油脱硫的催化剂,其晶胞结构如图所示,则晶体中与每个O2-紧邻的O2-有______个(填数字)。
乙酸异戊酯是无色透明的液体,沸点142℃,可用作食品香料。合成方法如下:
CH3COOH+HO(CH2)2CH(CH3)CH3 ![]() CH3COO(CH2)2CH(CH3)CH3+H2O
CH3COO(CH2)2CH(CH3)CH3+H2O
步骤1.称取26.4g (0.3mol) 的异戊醇和21.6g (0.36mol) 乙酸,置于三口烧瓶中,加入适量FeCl3·6H2O 和几粒沸石。
步骤2.装上温度计和仪器B (如右图),回流1h。

步骤3.稍冷后将仪器B 改为蒸馏装置,收集粗馏份。
步骤4.反应结束后分别用饱和食盐水、碳酸氢钠溶液和水分别洗涤、分液。
步骤5.加入2g 无水MgSO4,进一步操作得到乙酸异戊酯。
(1)图中仪器A名称为______,仪器B 的作用是_______
(2)步骤1控制投料比n(乙酸)/n(异戊醇)=1.2,其目的是__________
(3)步骤4用“碳酸氢钠溶液”洗涤的目的是_______; 分液时用到的主要玻璃仪器是______ (写名称)。
(4)步骤5 经MgSO4干燥后,_________得到乙酸异戊酯。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com