
| A. | 18O是氧元素的一种核素,它的中子数是8 | |
| B. | O4和O2是互为同位素 | |
| C. | 同温同压下,等体积的O4气体和O2含有相同的分子数 | |
| D. | O4转化O2为物理性质 |
分析 A.根据原子符号中,左下角数字表示质子数,左上角数字为质量数,中子数=质量数-质子数分析;
B.有相同质子数,不同中子数的原子互为同位素,相同元素组成,不同形态的单质互为同素异形体;
C.同温同压下,Vm相同,同温同压下,相同体积的任何气体含有相同分子数;
D.物理变化与化学变化的本质区别是否有新物质的生成;
解答 解:A.18O的质子数是8,质量数是18,中子数=质量数-质子数=18-8=10,故A错误;
B.O4和O2都是由氧元素形成的不同单质,故互为同素异形体,故B错误;
C.O4和O2都是气体,同温同压条件下,Vm相同,则相同体积的任何气体具有相同的分子数,故C正确;
D.O4和O2不是同种物质,所以O4转化O2为化学变化,故D错误;
故选C.
点评 本题考查了核素的表示方法、同位素、阿伏伽德罗定律、化学变化和物理变化区别,属于对基础知识的考查,题目难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
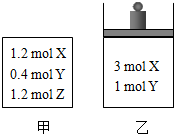 在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )| 恒容容器甲 | 恒压容器乙 | |
| Y的物质的量/mol | n1 | n2 |
| Z的体积分数 | φ1 | φ2 |
| A. | 平衡时容器乙的容积一定比反应前大 | |
| B. | 平衡时容器甲的压强一定比反应前大 | |
| C. | n2>n1 | |
| D. | φ2>φ1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | X位于元素周期表中第2周期、第VA族 | |
| B. | Y的氢化物(H2Y)不稳定,100℃以上即可分解 | |
| C. | W的非金属性比Y的非金属性弱 | |
| D. | Z的最高价氧化物的水化物是一种强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
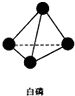 ,并指出1mol白磷(P4)含有P-P键的数目6NA
,并指出1mol白磷(P4)含有P-P键的数目6NA查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 元素R对应气态氢化物的相对分子质量实际测量值往往比理论上要大的多,这可能和氢键有关 | |
| B. | 由于键能H-R>H-T,故元素R、T对应气态氢化物的沸点:HR>HT | |
| C. | R与Q的电子数相差16 | |
| D. | 最高价氧化物对应的水化物的酸性:X<T<Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③⑥ | C. | ③④⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镶嵌冰密度不可能比4℃水大 | |
| B. | 镶嵌冰中四角形环比八角形环中水分间的氢键键能强 | |
| C. | 每个水分子形成两个氢键 | |
| D. | 镶嵌冰属于分子晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com