
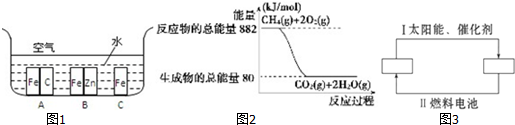
分析 (1)金属腐蚀的速度:原电池的负极金属>金属的化学腐蚀>有保护措施的腐蚀;
(2)根据图示写出1 mol CH4完全燃烧生成气态水时的热化学方程式,然后结合每摩尔水由气态变为液态时放出44kJ,根据盖斯定律来解答;
(3)①分析转化关系可知氢能源循环体系图中,燃料电池是氢气和氧气反应燃烧生成水的过程,水在太阳能和催化剂作用下分解有生成氧气和氢气;
②过程Ⅱ是发生的原电池反应;
③根据题中信息绿色化学的要求:反应物全部转化为期望的产物,使原子的利用率达到100%,可知化合反应、加成反应符合绿色化学的要求;需要的条件越简单,越节能.
解答 (1)解:铁处于A的环境中做原电池的负极,腐蚀速率较快,铁处于B的环境中做原电池的正极,被保护,腐蚀速率很慢,铁处于C的环境中的金属铁发生吸氧腐蚀,速度较慢.
故答案为:A>C>B;
(2)由图知1 mol CH4完全燃烧生成气态水时放出热量为(882-80)kJ=802 kJ,
热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802 kJ/mol①
又知每摩尔水由气态变为液态时放出44kJ:H2O(g)=H2O(l)△H=-44KJ/mol②
根据盖斯定律,将①+②×2可得:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=(-802 kJ/mol)+2×(-44KJ/mol)=-890 kJ/mol
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol;
(3)①转化关系可知氢能源循环体系图中,燃料电池是氢气和氧气反应燃烧生成水的过程,水在太阳能和催化剂作用下分解有生成氧气和氢气,两个框中的X、Y为循环过程中反应物和生成物的分子式为:左边为H2O;右边为H2、O2;
故答案为:左边为H2O;右边为H2、O2;
②过程Ⅱ是发生的原电池反应,能量变化是化学能转化为电能的过程;
故答案为:化学;电;
③C需要的条件是自然界中存在的太阳光,其他反应需要特定的催化剂,所以C最节能,根据题中信息绿色化学的要求:反应物全部转化为期望的产物,使原子的利用率达到100%,可知C是化合反应,原子利用率最高.
故答案为:C;B.
点评 本题考查学生金属的腐蚀速率快慢比较、盖斯定律的应用和反应热的求算、化学反应过程中能量变化形式、原电池原理的分析应用等知识,难度不大,综合性强.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题
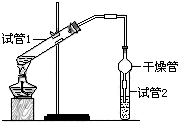 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.为证明浓硫酸在实
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.为证明浓硫酸在实| 实验 编号 | 试管1中的试剂 | 试管2中试剂 | 测得有机层的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和碳酸钠溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
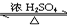 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④①③ | B. | ②①④③ | C. | ①②③④ | D. | ①②④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

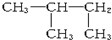



查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数相同的不同原子,其化学性质一定相同 | |
| B. | 质子数相同的原子,其核外电子排布也相同 | |
| C. | 金属性越强,其原子在反应中越易失去电子 | |
| D. | 非金属性越强,其阴离子越难失去电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,其合成过程中涉及的反应类型分别是( )
,其合成过程中涉及的反应类型分别是( )| A. | ①③ | B. | ①② | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 | |
| B. | 乙醇、苯酚都有羟基,但是电离常数不同 | |
| C. | 苯酚无需催化剂即能与溴水发生取代反应 | |
| D. | 1 mol甲苯能与3 mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
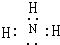 ,实验室制取该氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
,实验室制取该氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com