
分析 (1)根据H3PO2是一元中强酸可知,H3PO2是弱电解质,溶液中部分电离出氢离子,据此写出电离方程式;
(2)①先判断氧化剂、氧化剂,然后根据氧化剂与还原剂的物质的量之比为4:1来判断氧化产物;
②根据H3PO2是一元中强酸,可以判断NaH2PO2为正盐;
(3)白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,书写化学方程式.
解答 解:(1)H3PO2是一元中强酸,溶液中部分电离出氢离子,所以其电离方程式为:H3PO2?H2PO2-+H+,
故答案为:H3PO2?H2PO2-+H+;
(2)①该反应中Ag+为氧化剂,H3PO2为还原剂,氧化剂与还原剂的物质的量之比为4:1,设反应产物中P的化合价为x,根据化合价升降相等可得,4×(1-0)=1×(x-1),解得x=5,所以氧化产物为+5价的H3PO4,反应中Ag+为氧化剂,H3PO2为还原剂,P的化合价升高了4价,银的化合价也应该降低4价,所以Ag元素的前边都是系数4,反应的方程式为H3PO2+4AgNO3+2H2O=4Ag↓+4HNO3+H3PO4,所以氧化产物为H3PO4,故答案为:H3PO4;
②由于H3PO2是一元中强酸,所以NaH2PO2为正盐,是强碱弱酸盐,水解呈碱性,
故答案为:正盐,弱碱性;
(3)白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,反应方程式为2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,
故答案为:2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑.
点评 本题考查了盐的水解原理、弱电解质的电离、氧化还原反应等知识,题目难度中等,试题涉及的知识点较多,充分考查了学生对所学知识的掌握情况.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
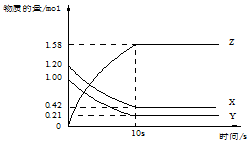 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.158mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应的化学方程式为:X(g)+Y(g)?Z(g) | |
| D. | 反应开始到10s时,Y的转化率为79.0% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
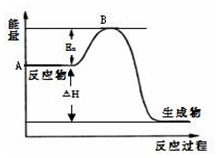 2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:
2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
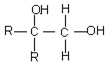 $\stackrel{氧化}{→}$
$\stackrel{氧化}{→}$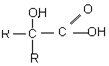

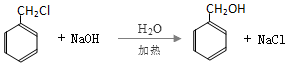 ;
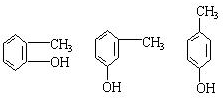
;
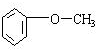
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑦ | B. | ①⑤⑥ | C. | ②③④⑦ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水的颜色呈浅绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有 H+ | |
| D. | 新制的氯水能使红色布条褪色,说明氯水中含有Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
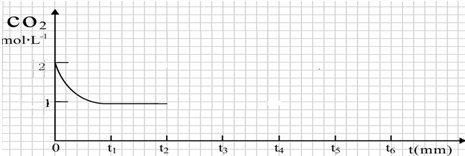
| 反应条件 | 反应时间 | CO2 (mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 恒温恒容 (T1℃、2L) | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com