
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
| 1 |
| 2 |
| 1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
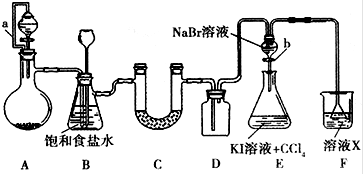
| ① | ② | ③ | ④ | |
| Ⅰ | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| Ⅱ | 碱石灰 | 氯化钙 | 硅胶 | 氯化钠 |
| Ⅲ | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
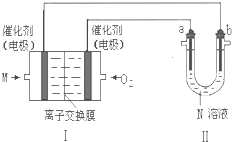 A、B、C、D、E为短周期元素,且原子序数依次递增.其中B元素形成化合物种类最多,A、E同主族.A与 E的质子数之和是B质子数的2倍,且E与D分别形成的最简单离子都含有10个电子.由以上元素组成的物质BD和C2具有相同的电子数.
A、B、C、D、E为短周期元素,且原子序数依次递增.其中B元素形成化合物种类最多,A、E同主族.A与 E的质子数之和是B质子数的2倍,且E与D分别形成的最简单离子都含有10个电子.由以上元素组成的物质BD和C2具有相同的电子数.查看答案和解析>>
科目:高中化学 来源: 题型:
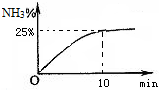 含氮化合物对人类生活有十分重大的意义.
含氮化合物对人类生活有十分重大的意义.| T/℃ | 30 | 40 | 50 |
| NH3生成量/10-6mol | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com