
【题目】在容积为1 L的恒容密闭容器中充入CO(g)和H2O(g),发生反应:CO(g) + H2O(g)![]() CO2(g) + H2(g) ΔH<0,所得实验数据如下表:
CO2(g) + H2(g) ΔH<0,所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(CO) | n(H2O) | n(CO2) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是
A. 实验①中,若5 min时测得n (CO2) =0.050 mol,则0至5 min时间内,用H2表示的平均反应速率υ (H2) = 5.0×10-2 mol/(L·min)
B. 实验②中,该条件下反应的平衡常数K =2.0
C. 实验③中,达到平衡时,CO的转化率为60%
D. 实验④中,达到平衡时,b>0.060
【答案】C
【解析】
A.速率之比等于化学计量数之比,则v(H2)=v(CO2)=![]() =
=![]() = 1.0×10-2mol/(Lmin),A项错误;
= 1.0×10-2mol/(Lmin),A项错误;
B.实验②中平衡时CO2为0.080 mol,则:
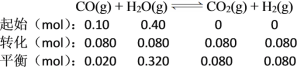
由于反应中气体的化学计量数相等,可以用物质的量代替浓度计算平衡常数,故实验②中,该反应的平衡常数K = ![]() =
=![]() = 1,B项错误;
= 1,B项错误;
C.温度不变,平衡常数不变,则K=1,因平衡时n(CO2) = a mol,则列三段式如下:
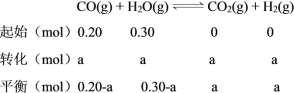
则K=![]() =1,解得a=0.12,实验③中CO的转化率=
=1,解得a=0.12,实验③中CO的转化率=![]() ×100%=60%,C项正确;
×100%=60%,C项正确;
D.该反应为放热反应,则升高温度,平衡常数K减小,所以K(900℃)<K(800℃)<1,平衡时CO2为b mol,则:

则K=![]() <1,解得b < 0.060,D项错误;
<1,解得b < 0.060,D项错误;
答案为C。


科目:高中化学 来源: 题型:
【题目】已知: (1)Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
![]() 则
则![]() 的ΔH是( )
的ΔH是( )
A.-824.4 kJmol-1B.-627.6kJmol-1C.-744.7kJmol-1D.-169.4kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢卤酸的能量关系如图所示下列说法正确的是
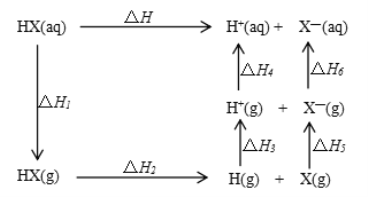
A. 已知HF气体溶于水放热,则HF的△H1<0
B. 相同条件下,HCl的△H2比HBr的小
C. 相同条件下,HCl的△H3+△H4比HI的大
D. 一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,可逆反应:A(g)+B(g)![]() xC(g),符合下列图象(Ⅰ)所示关系。由此推断对图(Ⅱ)的正确说法是( )
xC(g),符合下列图象(Ⅰ)所示关系。由此推断对图(Ⅱ)的正确说法是( )
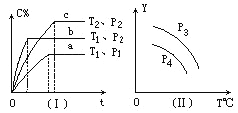
A. P3>P4,Y轴表示A的质量
B. P3<P4,Y轴表示B的百分含量
C. P3>P4,Y轴表示混合气体密度
D. P3>P4,Y轴表示混合气体平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C和CuO在高温下反应可能生成Cu、![]() 、
、![]() 、CO。现将
、CO。现将![]() 碳粉跟
碳粉跟![]() 混合,在硬质试管中隔绝空气高温加热,将生成的气体全部通入足量NaOH溶液中,并收集残余的气体,测得溶液增加的质量为
混合,在硬质试管中隔绝空气高温加热,将生成的气体全部通入足量NaOH溶液中,并收集残余的气体,测得溶液增加的质量为![]() ,残余气体在标准状况下的体积为
,残余气体在标准状况下的体积为![]() 。下列说法不正确的是
。下列说法不正确的是
A.在硬质试管中隔绝空气高温加热固体混合物时,有![]() 碳参加了反应
碳参加了反应
B.试管中发生的所有氧化还原反应共转移电子![]()
C.反应后试管中剩余的固体混合物的总质量为![]()
D.反应生成铜和氧化亚铜的总物质的量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生成氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g)![]() H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,该反应在低温下________(“能”或“不能”)自发进行。
H2(g)+CO(g) ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,该反应在低温下________(“能”或“不能”)自发进行。
(2)已知在400 ℃时,N2(g)+3H2(g)![]() 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。
①在400 ℃时,2NH3(g)![]() N2(g)+3H2(g)的K′=________(填数值)。
N2(g)+3H2(g)的K′=________(填数值)。
②400 ℃时,在0.5 L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2 mol、1 mol、2 mol,则此时反应v正(N2)________(填“>”“<”“=”或“不能确定”)v逆(N2)。
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡________(填“向左”“向右”或“不”)移动;使用催化剂________(填“增大”“减小”或“不改变”)反应的ΔH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是
A.过量的铁在1molCl2中然烧,最终转移电子数为2NA
B.在50g质量分数为46%的乙醇水溶液中,含氢原子总数为6NA
C.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
D.1L1mol/LNaCl溶液和1L1mol/LNaF溶液中离子总数:前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为几种晶体或晶胞的示意图:
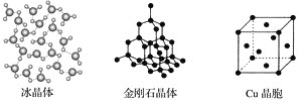
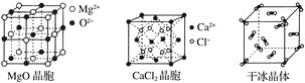
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是____。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为:___。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能___(填“大于”或“小于”)MgO晶体,原因是____。
(4)每个Cu晶胞中实际占有___个Cu原子,CaCl2晶体中Ca2+的配位数为__。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2012年4月,中央电视台曝光了不法商贩将重金属铬![]() 超标的工业明胶加工成药用胶囊的“毒胶囊”事件.已知铬的原子序数为24,下列叙述正确的是
超标的工业明胶加工成药用胶囊的“毒胶囊”事件.已知铬的原子序数为24,下列叙述正确的是
A.铬位于元素周期表的第四周期第Ⅷ族
B.警察通过装有橙色的酸性重铬酸钾的装置检查司机是否酒后驾车
C.已知铬元素的一种同位素的质量数为53,则该同位素有53个中子
D.中子数为29的铬原子符号表示为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com