
【题目】下列符合中,表示2个氢分子的是( )
A.H2
B.2H
C.2H2
D.2H+
科目:高中化学 来源: 题型:
【题目】化学上常用AG 表示溶液中的酸碱度,AG=lg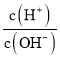 。25℃时,用0.100mol·L-1的NaOH 溶液滴定20.00mL 0.100mol·L-1HNO2溶液,AG与所加NaOH 溶液的体积(V)关系如图所示,下列说法正确的是( )
。25℃时,用0.100mol·L-1的NaOH 溶液滴定20.00mL 0.100mol·L-1HNO2溶液,AG与所加NaOH 溶液的体积(V)关系如图所示,下列说法正确的是( )
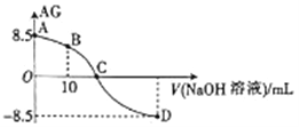
A. B点溶液中存在c(H+)-c(OH-)=c(NO2-)-c(HNO2)
B. D点溶液中的pH=11.25
C. C点时,加入NaOH 溶液的体积为20.00 mL
D. 25 ℃时,HNO2 的电离平衡常数Ka=1.0×10-5.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种重要的化工原料,既可用于制药,又可用作火箭燃料。回答下列问题:
(1)已知反应的热化学方程式如下:
①N2H4(g)![]() N2(g)+2H2(g) △H1;
N2(g)+2H2(g) △H1;
②N2(g)+3H2(g)![]() 2NH3(g) △H2。
2NH3(g) △H2。
反应热△H1 _____(填“大于”或“小于”) △H2。向2 L的恒容密闭容器中充入1 mol N2H4,发生反应①,![]() (用x表示)与时间的关系如图1所示,则该温度下,反应①的平衡常数K=___________________。
(用x表示)与时间的关系如图1所示,则该温度下,反应①的平衡常数K=___________________。

(2)肼在另一条件下也可达到分解平衡,同时生成两种气体,且其中一种气体能使湿润的红色石蕊试纸变蓝。图2为平衡体系中肼的体积分数与温度、压强的关系。
①该反应的化学方程式为________________________________________。
②p2_______ (填“大于”或“小于”) p1。
③图中N2H4的平衡体积分数随温度升高而降低,其原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HR是一元酸。室温时,用0.250 mo·L-1NaOH 溶液滴定25.0 mLHR溶液时,溶液的pH 变化情况如图所示。其中,b 点表示两种物质恰好完全反应。下列叙述正确的是

A. HR 的电离常数Ka=5×10-6
B. 图中X<7
C. a 点溶液中粒子浓度大小关系是:c(Na+)>c(R-)>c(HR)>c(H+)>c(OH-)
D. b 点溶液中粒子浓度大小关系是:c(Na+)>c(OH-)>c(R-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2+I2+2H2O===H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量。

(1)若原料气从左流向右时,上述装置组装连接的顺序:原料气→__________________(填“a”“b”“c”“d”“e”)。
(2)装置Ⅱ中发生反应的离子方程式为_____________;当装置Ⅱ中出现________现象时,立即停止通气。
(3)若碘溶液的浓度为0.05 mol/L、体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积),SO2的体积分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用如图所示的装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请回答下列问题:
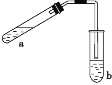
(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2 mL,加入的操作顺序是 。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是 。
(3)写出实验中加热试管的目的:① ;② 。
(4)试管b中盛有饱和Na2CO3溶液,其作用是 。
(5)反应结束后,振荡试管b,静置,观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若有A、B、C三种烃的衍生物,相互转化关系如下:
1,2二溴乙烷![]() 气体D
气体D![]() A
A![]() B
B![]() C
C
C跟石灰石反应产生使澄清石灰水变浑浊的气体。
(1)A、B、C中所含官能团的名称是 、 、 。
(2)书写下列反应的化学方程式
A→B的化学方程式为: ___________________
B→C的化学方程式为: ___________________
B→A的化学方程式为: ___________________
(3)上述A、B、C、D四种物质还原性最强的是 (填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读题目,回答问题。
(1)已知: P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1, P4(s)+10Cl2(g)=4PCl5(g) ΔH=b kJ·mol-1,P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol-1,PCl3中P—Cl键的键能为1.2c kJ·mol-1。请回答:PCl3(g)和氯气反应生成PCl5(g)的热化学方程式为________________________________,Cl—Cl 键的键能为_________________________。
(2)离子液体是一种室温熔融盐非水体系。由有机阳离子、Al2Cl7-利AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝。则钢制品应接电源的__________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为_________________________。
(3)人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图
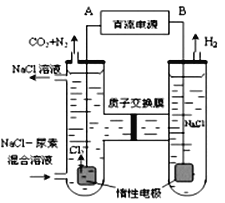
①电源的负极为_____________(填“A”或“B”)。
②阳极室中发生的反应为_____________________,______________________。
③电解结束后,阴极室溶液的pH 与电解前相比将____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com