
【题目】在粗盐提纯的实验中,不需要的仪器是:
A. 坩埚 B. 蒸发皿 C. 玻璃棒 D. 漏斗
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)将FeCl3溶液滴入沸水可以制得Fe(OH)3胶体。鉴别Fe(OH)3胶体和FeCl3溶液的方法是____________________________________。
(2)胶体区别于其他分散系的本质特征是__________________________________。
(3)人体不易吸收三价铁,所以常用硫酸亚铁治疗缺铁性贫血。解释补铁的同时服用维生素C的原因__________________________________________________。
(4)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式__________________________________________。
工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
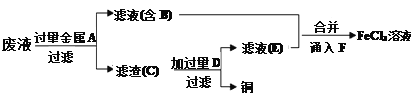
根据上述设计方案并结合所学知识回答以下问题。
(5)检验滤液E中金属阳离子的方法是___________________________________。
(6)通入F发生反应的离子方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于烃的说法正确的是( )
A.苯和甲苯均能使酸性高锰酸钾溶液褪色
B.CH2=C(CH3)-CH=CH2与等物质的量的溴反应产物仅有2种
C.分子式为C8H10且属于芳香烃的同分异构体有3种
D.等质量的乙烷、乙烯完全燃烧消耗氧气的量前者多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想将碳酸钙通过特殊的加工方法使之变为纳米碳酸钙(碳酸钙粒子直径是几纳米—几十纳米),这将引起建筑材料的性能发生巨变。下列关于纳米碳酸钙的推测可能的是( )
A. 纳米碳酸钙的水溶液会混浊不清
B. 纳米碳酸钙分散到水中能产生丁达尔效应
C. 纳米碳酸钙化学性质已与原来碳酸钙完全不同
D. 纳米碳酸钙的粒子不能透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然碳元素的相对原子质量为 12.01,若在自然界碳元素有12C、13C两种同位素,则 12C与13C的质量比为:
A. 等于 1:99 B. 大于 99:1 C. 等于 99:1 D. 小于 99:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有pH=1的某溶液中可能含有Na+、Fe2+、Fe3+、I﹣、Cl﹣、CO32﹣中的某几种,现取100mL该溶液进行如下实验: 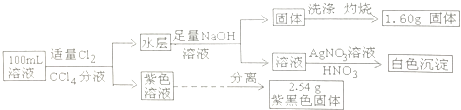
根据实验结果,下列判断正确的是( )
A.Fe2+、I﹣、Cl﹣三种离子一定存在
B.不能确定Na+和Cl﹣是否存在,CO ![]() 一定不存在
一定不存在
C.Fe3+与Fe2+至少有一种
D.该溶液中c(Cl﹣)≥0.1mol?L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图六,下列说法正确的是
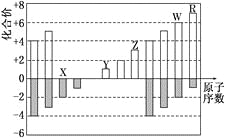
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:R>W
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物的碱性:Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:___________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g) ![]() CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g) ![]() CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g) ![]() CH3OCH3(g) + CO2 (g)的ΔH= ___________;
CH3OCH3(g) + CO2 (g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g) ![]() CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。达到平衡时甲醇的转化率α(CH3OH)= _________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种既能提供电能又能固氮的新型氢氮燃料电池的工作原理如图所示,其中电解质溶液为溶有化合物A的稀盐酸。下列有关表述错误的是( )
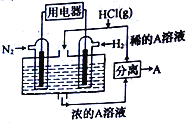
A. 通入N2的电极发生的电极反应式为N2+6e-+8H+=2NH4+
B. 该装置能将化学能转化为电能,化合物A为NH4Cl
C. 电子从通入N2的电极流出,经过用电器流向通入H2的电极
D. 反应过程中电解质溶液的pH会变大,故需要通入氯化氢气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com