
| A、常温下0.4 mol/L HB溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(H+)>c(Na+)>c(OH-) |
| B、常温下0.1 mol/L、pH为4的NaHB溶液中:c(HB-)c(H2B)>c(B2-) |
| C、常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH4Cl③NH3?H2O④CH3COONH4中,c(NH+4)由大到小的顺序是:②>①>④>③ |
| D、常温下pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等 |


科目:高中化学 来源: 题型:
| A、3.2 g O2与O3的混合物中含有的氧原子数为0.2NA |
| B、标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA |
| C、标准状况下,30gNO和16gO2混合所生成的气体分子数为NA |
| D、标准状况下电解硫酸铜溶液时,阳极每生成气体3.36 L,转移电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
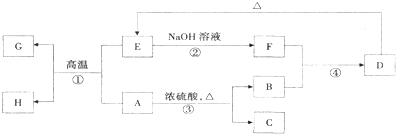
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9gD2O中含有的质子数为5NA |
| B、1molCaCl2中含有的离子数为3NA |
| C、30g甲醛中含共用电子对总数为4NA |
| D、71gCl2与足量NaOH溶液反应转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其中所含Na2O2分子的数目为0.1NA |
| B、其中所含离子数目为0.4NA |
| C、与足量的H2O反应,生成O2的分子数目为0.1NA |
| D、与足量的CO2反应,电子转移数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42- |
| B、水电离出的c(H+)=1×10-13mol/L的溶液中:K+、HCO3-、Cl-、S2- |
| C、使紫色石蕊试液显蓝色的溶液中:Mg2+、NO3-、Fe3+、SO42- |
| D、溶有碳酸氢钠的溶液:K+、SO42-、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
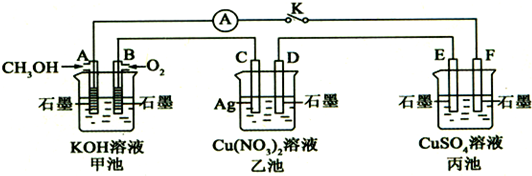
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.012kg12C中含有约6.02×1023个碳原子 |
| B、1molH2O中含有2 mol氢和1mol氧 |
| C、氢氧化钠的摩尔质量是40g |
| D、2mol水的摩尔质量是1mol水的摩尔质量的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将氢氧化钠固体放在天平托盘的滤纸上,精确称量并放入烧杯中溶解后,立即注入容量瓶中 |
| B、将准确量取的18.4mol?L-1的硫酸10mL,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线 |
| C、仰视容量瓶刻度线,看到液面超过了容量瓶的刻度线,用胶头滴管吸出刻度线以上的溶液 |
| D、欲配制1000mL 0.1mol?L-1的盐酸,将稀释后的盐酸溶液全部转移到未经干燥的1000mL的容量瓶中,加水至刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com