
分析 某无色固体,仅由Cu2+、K+、NH4+、Cl-、SO42-、NO3-、I-可能含有其中的两种或两种以上的组成,做如下实验:(1)溶于水得无色溶液,则一定不存在Cu2+;(2)在溶液中加浓硫酸无变化,则一定不含I-,再加铜片并加热浓缩,有红棕色气体产生,则一定含有NO3-;(3)取(1)的溶液加入NaOH溶液并加热,无明显变化,则一定不存在NH4+;结合溶液电中性可知一定含有K+,据此进行解答.
解答 解:(1)溶于水得无色溶液,则一定不存在有色的Cu2+;(2)在溶液中加浓硫酸无变化,则一定不含I-,再加铜片并加热浓缩,有红棕色气体产生,该气体为二氧化氮,则一定含有NO3-;(3)取(1)的溶液加入NaOH溶液并加热,无明显变化,则一定不存在NH4+,结合溶液电中性可知一定含有K+,
根据分析可知,原固体中一定含有:K+、NO3-,一定没有的离子为:Cu2+、NH4+、I-,可能含有的离子为:Cl-、SO42-,
故答案为:K+、NO3-;Cu2+、NH4+、I-;Cl-、SO42-.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意熟练掌握常见离子的检验方法,试题侧重考查学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
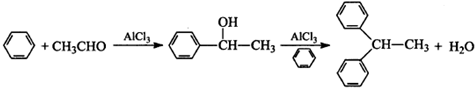
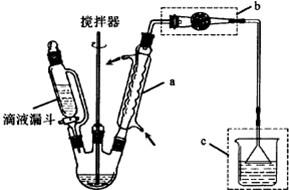
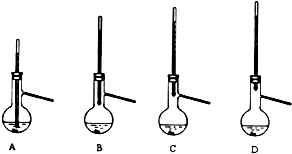
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe3+、SO42-、I- | B. | H+、NH4+、HCO3-、NO3- | ||
| C. | K+、AlO2-、Cl-、OH- | D. | Ag+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
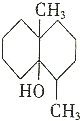 当天空降雨时,雨水会刺激土壤释放出一种称为土臭素的化学物质,其结构简式如图所示.下列试剂(可加热)不与土臭素反应的是( )
当天空降雨时,雨水会刺激土壤释放出一种称为土臭素的化学物质,其结构简式如图所示.下列试剂(可加热)不与土臭素反应的是( )| A. | 金属钠 | B. | 醋酸和浓硫酸的混合溶液 | ||
| C. | 酸性高锰酸钾溶液 | D. | 碳酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
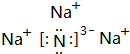 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
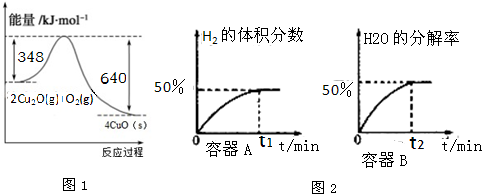
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
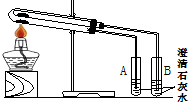 (1)为比较Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验装置.实验时,先检查装置的气密性,再取少量Na2CO3粉末加在大试管的底部,另取少量NaHCO3粉末加在小试管底部.预热后在大试管底部加热.
(1)为比较Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验装置.实验时,先检查装置的气密性,再取少量Na2CO3粉末加在大试管的底部,另取少量NaHCO3粉末加在小试管底部.预热后在大试管底部加热.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被重结晶提纯的物质的溶解度随温度变化大 | |
| B. | 溶解度很小的杂质留在了热滤的滤渣里 | |
| C. | 重结晶的步骤为:加热溶解、冷却过滤、结晶 | |
| D. | 重结晶的首要工作是选择适当的溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
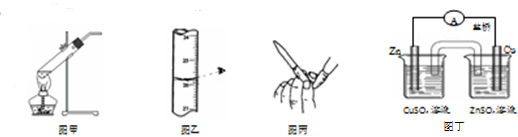
| A. | 用图甲所示装置加热分解NaHCO3固体 | |
| B. | 用图乙所示读取滴定管读数 | |
| C. | 用图丙所示排碱式滴定管尖嘴内的气泡 | |
| D. | 用图丁所示装置构成铜锌原电池 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com