
【题目】砷(33As)在元素周期表中与氮同主族,砷及其化合物被运用在农药、防腐剂、染料和医药等领域,及其多种合金中。
(1)砷原子次外层上的电子数为_____,砷化氢的电子式为_______。
(2)成语“饮鸩止渴”中的“鸩”是指放了砒霜(As2O3)的酒。As2O3是两性偏酸性的氧化物,写出As2O3溶于浓盐酸的化学方程式__________。
(3)As2O3溶于热水生成的亚砷酸(H3AsO3),具有较强的还原性,分可用于治疗白血病,其水溶液存在多种微粒形态,各微粒的分布分数与溶液pH的关系如图:

①向亚砷酸溶液中缓缓加入NaOH溶液至pH=11时,反应的离子方程式为_________。
②电离平衡常数Ka1(H3AsO3)=________。
③Na2HAsO3溶液呈碱性,该溶液中c(H2AsO3-)_____c(AsO33-)(填“>”、“<”或“=”)。
④向含有HAsO32-的溶液中滴加氯水反应的离子方程式为_________。
【答案】 18  As2O3+6HCl=2AsCl3+3H2O H3AsO3+OH-=H2AsO3-+H2O 10-9.2 > HAsO32-+H2O+Cl2=H3AsO4+2Cl-
As2O3+6HCl=2AsCl3+3H2O H3AsO3+OH-=H2AsO3-+H2O 10-9.2 > HAsO32-+H2O+Cl2=H3AsO4+2Cl-
【解析】(1)本题考查电子式的书写,As位于第四周期VA族,根据核外电子排布规律,原子结构示意图为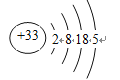 ,次外层电子数为18,其氢化物是AsH3,电子式为
,次外层电子数为18,其氢化物是AsH3,电子式为 ;(2)本题考查化学反应方程式的书写,As2O3是两性偏酸性的氧化物,与酸发生复分解反应,即反应方程式为As2O3+6HCl=2AsCl3+3H2O;(3)①本题考查离子反应方程式的书写,pH=11时,溶液中As元素以H2AsO3-形式存在,H3AsO3几乎完全消耗,因此离子反应方程式为H3AsO3+OH-=H2AsO3-+H2O ;②本题考查电离平衡常数的计算,H3AsO3是弱酸,存在H3AsO3
;(2)本题考查化学反应方程式的书写,As2O3是两性偏酸性的氧化物,与酸发生复分解反应,即反应方程式为As2O3+6HCl=2AsCl3+3H2O;(3)①本题考查离子反应方程式的书写,pH=11时,溶液中As元素以H2AsO3-形式存在,H3AsO3几乎完全消耗,因此离子反应方程式为H3AsO3+OH-=H2AsO3-+H2O ;②本题考查电离平衡常数的计算,H3AsO3是弱酸,存在H3AsO3 ![]() H++H2AsO3-,电离平衡常数Ka1=c(H2AsO3-)×c(H+)/c(H3AsO3),利用pH=9.2,此时c(H3AsO3)=c(H2AsO3-),因此Ka1=c(H+)=10-9.2;③考查酸式盐溶液的酸碱性,NaHAsO3溶液显碱性,说明HAsO3-以水解为主,因此c(H2AsO3-)>c(AsO33-);④考查氧化还原反应方程式的书写,HAsO32-中As显+3价,具有还原性,氯水具有强氧化性,把As氧化成+5价,即离子反应方程式为 HAsO32-+H2O+Cl2=H3AsO4+2Cl-。
H++H2AsO3-,电离平衡常数Ka1=c(H2AsO3-)×c(H+)/c(H3AsO3),利用pH=9.2,此时c(H3AsO3)=c(H2AsO3-),因此Ka1=c(H+)=10-9.2;③考查酸式盐溶液的酸碱性,NaHAsO3溶液显碱性,说明HAsO3-以水解为主,因此c(H2AsO3-)>c(AsO33-);④考查氧化还原反应方程式的书写,HAsO32-中As显+3价,具有还原性,氯水具有强氧化性,把As氧化成+5价,即离子反应方程式为 HAsO32-+H2O+Cl2=H3AsO4+2Cl-。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池具有高效率输出、可快速充电、对环境无污染等优点,其工作原理如图。M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xFeO4![]() LiFePO4+6C。下列说法正确的是( )
LiFePO4+6C。下列说法正确的是( )

A. 放电时Li+从右边移向左边 B. 放电时M是负极,电极反应式为:C6x--xe-=6C
C. 充电时电路中通过0.5mol电子,消耗36gC D. 充电时N极连接电源的正极,电极反应式为:LiFePO4-xe-= Li1-xFeO4+xLi+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.76克铜镁合金完全溶解于50mL密度为1.40g/cm3质量分数为63%的浓硝酸中,得到NO2 气体1792mL (标准状况),向反应后的溶液中加入适量的1.0mol/LNaOH溶液,恰使溶液中的金属离子全部沉淀下列说法不正确的是( )
A. 该浓硝酸中HNO3的物质的量浓度是14.0mol/L
B. 加入NaOH溶液的体积是50mL
C. 浓硝酸在与合金反应中起了酸性和氧化性的双重作用
D. 得到的金属氢氧化物的沉淀为3.12克
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的1/4,C元素的最高价氧化物的水化物是一种中强碱。甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005mol/L戊溶液的pH=2 ,它们之间的转化关系如下图所示(部分反应物省略),下列叙述正确的是

A. C、D两元素形成化合物属共价化合物
B. A、D分别与B元素形成的化合物都是大气污染物
C. C、D的简单离子均能促进水的电离
D. E的氧化物水化物的酸性大于D的氧化物水化物的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知H-H键键能(化学键断裂时吸收或形成时释放的能量)为436 kJ/mol,N-H键键能为391 kJ/mol,根据热化学方程式:N2(g)+3H2(g)=2NH3(g) △H =-92.4 kJ/mol,可知 N≡N键的键能是
A. 431kJ/molB. 946 kJ/molC. 649 kJ/molD. 896 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是 ( )
A. 向容量瓶中转移溶液时,瓶事先用蒸馏水洗涤过
B. 称量时NaOH已经潮解
C. 定容时俯视容量瓶的标线
D. 摇匀后发现液面低于标线,未做处理。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于水与生命活动的说法,不正确的是
A. 细胞发生癌变,其自由水含量较正常细胞的低
B. 正在萌发的种子中结合水与自由水的比值降低
C. 在线粒体,叶绿体和核糖体中进行的化学反应都有水生成
D. 自由水和结合水在一定的条件下可以相互转化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com