
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.Zn+H2SO4=ZnSO4+H2↑;B.NaOH+HCl=NaCl+H2O。能设计成原电池的反应是__________(填“A”或“B”)。
(2)将锌片和铜片按如图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置
B.甲中铜片质量减少、乙中锌片质量减少
C.两烧杯中溶液的c(H+)均减小
②在相同时间内,两烧杯中产生气泡的速度:甲__________乙(填“>”、“<”或“=”)。
③请写出图中构成原电池的正极电极反应式:__________。
④当乙中产生2.24 L(标准状况)气体时,将锌铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.2 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为__________。
【答案】A C > 2H++2e-=H2↑ 2mol/L
【解析】
(1)自发的氧化还原反应才能设计成原电池;
(2)①甲装置符合原电池构成条件,是原电池,乙不能形成闭合回路,不能构成原电池,两个烧杯中锌都失电子发生氧化反应,甲中铜上氢离子得电子发生还原反应,乙中锌上氢离子得电子发生还原反应;
②作原电池负极的金属加速被腐蚀;
③原电池正极是氢离子得电子发生还原反应;
④先计算氢离子的物质的量再计算原来稀硫酸的浓度。
(1)反应A.Zn+H2SO4=ZnSO4+H2↑是氧化还原反应,能设计成原电池反应,B.NaOH+HCl=NaCl+H2O不是氧化还原反应,不能设计成原电池,正确答案是:A。
(2)①A.甲形成原电池,是化学能转变为电能的装置,乙不是,A猎误;
B.甲、乙中锌片质量都减少,铜片质量都不变,B错误;
C.两个烧杯中都产生氢气,氢离子浓度都降低,所以溶液的pH均增大,C正确;
所以选C。
②原电池原理引起的腐蚀速度大于化学腐蚀的速度,所以两烧杯中产生气泡的速度甲>乙,本题正确答案:>;
③构成原电池的正极是氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,本题正确答案是:2H++2e-=H2↑
④稀释后氢离子的物质的量为1 L×0.2 mol/L=0.2 mol,生成氢气2.24 L的物质的量为=0.1mol,消耗的氢离子物质的量为0.2 mol,所以原溶液中氢离子的物质的量为0.4 mol,原溶液中氢离子的浓度为![]() ,硫酸是二元强酸,所以原溶液中稀硫酸的浓度为2 mol/L,本题正确答案是2 mol/L。
,硫酸是二元强酸,所以原溶液中稀硫酸的浓度为2 mol/L,本题正确答案是2 mol/L。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】向xmL 0. 1 mol/L氨水中滴加等物质的量浓度的稀H2SO4 ,测得混合溶液的温度和pOH[pOH==-lg c(OH-)]随着加入稀硫酸的体积的变化如图所示(实线为温度变化,虚线为pOH变化)。下列说法不正确的是

A. x=40
B. a, b,c三点由水电离出的c(H+)依次减小
C. b点时溶液的pOH>pH
D. a,b.d三点对应的NH3·H2O的电离常数:K(b)>K(d)>K(a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线如下:
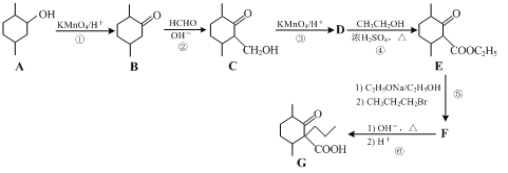
⑴下列说法正确的是______。
A.可以用NaHCO3溶液鉴别化合物A和G
B.有机物A分子中只含有2个手性碳原子
C.化合物B分子中所有碳原子可能位于同一平面
D.1 mol化合物E最多可与1 mol NaOH反应
⑵反应②的反应类型是______。
⑶化合物F的结构简式是______。
⑷写出一种满足下列条件的C的同分异构体的结构简式:______。
Ⅰ.含有六元环;Ⅱ.能发生银镜反应和水解反应;Ⅲ.分子含5种不同化学环境的氢。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,则反应P4(白磷)+3O2=P4O6中消耗3 mol O2放出的热量为
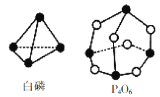
A.1368kJB.1498kJC.1638kJD.1683kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.Al、SiO2、Ca(OH)2、NaHCO3等既能与盐酸反应,又能与氢氧化钠溶液反应
B.若a、b、c分別为Si、SiO2、H2SiO3,则可以通过一步反应实现如图所示的转化关系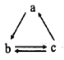
C.Fe2O3![]() Fe2(SO4)3(aq)
Fe2(SO4)3(aq)![]() 无水Fe2(SO4)3
无水Fe2(SO4)3
D.Na![]() Na2O2
Na2O2![]() NaI
NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为22.4 L。请计算(写出计算过程):
(1)NO标况下的体积________
(2)参加反应的HNO3的物质的量________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为V3++VO2++H2O![]() VO2++2H++V2+,下列说法正确的是( )
VO2++2H++V2+,下列说法正确的是( )
A. 放电时每转移2 mol电子,消耗1 mol氧化剂
B. 放电时正极反应为V O2++2H++e-=VO2++H2O
C. 放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D. 充电过程中,H+由阴极区向阳极区迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )

A. H2A为二元弱酸,稀释前c(H2A)=0.005mol/L
B. NaHA水溶液中:c(Na+)+ c(H+)= 2c(A2-)+ c(OH-)
C. 含等物质的量的NaHA、NaHB的混合溶液中:c(Na+)= c(A2-)+ c(B2-)+ c(HB-)+ c(H2B)
D. pH=10的NaHB溶液中,离子浓度大小为:c(Na+)>c(HB-)>c(OH-)>c(B2-)>c(H2B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆 开)1mol 化学键时释放(或吸收)的能量。已知白磷和![]() 的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P—P:198,P—O:360,O=O:498,则对于反应
的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P—P:198,P—O:360,O=O:498,则对于反应![]() 表述正确的是 ( )
表述正确的是 ( )
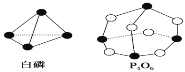
A.放出1638 kJ 的热量B.吸收1638 kJ 的热量
C.放出126 kJ 的热量D.吸收126 kJ 的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com