
分析 (1)令NO和NO2的物质的量分别为xmol、ymol,根据二者体积及电子转移守恒列方程计算,再根据V=nVm计算各自体积;
(2)根据N原子守恒计算作氧化剂的硝酸的物质的量,根据硝酸铜的化学式计算起酸作用的硝酸,两者之和即为参加反应的硝酸的物质的量;
(3)根据N原子守恒计算作氧化剂的硝酸的物质的量,根据硝酸钠的化学式计算起酸作用的硝酸,再根据物质的量浓度公式计算硝酸的物质的量浓度;
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,结合(1)根据得失电子守恒分析,或者硝酸钠中的氮是+5价,所以铜失电子全部给铜来求解.
解答 解:(1)32.64g铜的物质的量为$\frac{32.64g}{64g/mol}$=0.51mol,在反应中失去的电子的物质的量为2×0.51mol,11.2L混合气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,令NO和NO2的物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{x+y=0.5}\\{3x+y=0.51×2}\end{array}\right.$,
解得x=0.26、y=0.24,
NO的体积=0.26mol×22.4L/mol=5.824L
NO2的体积=0.24mol×22.4L/mol=5.376L
故答案为:5.824;5.376;
(2)根据N原子守恒,则作氧化剂的硝酸的物质的量为0.5mol,根据硝酸铜的化学式,则起酸作用的硝酸的物质的量为2×0.51mol=1.02mol,所以参加反应的硝酸的物质的量是0.5+1.02=1.52mol,故答案为:1.52;
(3)将铜离子完全转化为硝酸钠时,根据钠原子守恒得n(NaOH)=n(NaNO3)=0.001aVmol,根据硝酸根离子守恒得起酸作用的硝酸的物质的量=0.001aVmol,根据N原子守恒作氧化剂的硝酸的物质的量=0.5mol,所以硝酸的物质的量浓度=$\frac{0.5mol+0.001aVmol}{0.14L}$=$\frac{50+0.1aV}{14}$mol/L,
故答案为:$\frac{50+0.1aV}{14}$mol/L;
(4)设需要30%的双氧水mg,根据电子得失守恒,有:0.26×3+0.24×1=0.51×2=30%×$\frac{m}{34}$×2,解得:m=57.8,故答案为:57.8.
点评 本题以硝酸为载体考查了氧化还原反应的计算,根据氧化还原反应中得失电子进行解答即可,注意守恒思想的运用,注意(3)中不能根据铜计算消耗硝酸的物质的量,铜和硝酸反应时,硝酸可能有剩余,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 95%的酒精用于医疗中可作消毒剂,硫酸钡用于医疗中可作钡餐 | |
| B. | 食品中用木糖醇作甜味剂,可降低糖尿病的犯病几率 | |
| C. | 焊接废旧钢材前,分别用饱和Na2CO3溶液、NH4Cl溶液处理焊点 | |
| D. | 钙基固硫和NOx的催化转化都是解决空气污染问题的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L NO和11.2L O2在密闭容器中充分反应后,总分子数小于NA | |
| B. | 28g C2H4和C3H6的混合物含有C-H键数目为4NA | |
| C. | 标准状况下,22.4L Cl2与适量H2O或NaOH反应转移的电子数目都为NA | |
| D. | 常温下,1L pH=13的Ba(OH)2中OH-的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的化学方程式为:CO2+H2 $?_{高温}^{催化剂}$ CO+H2O | |
| B. | 恒温恒容下,增大压强,H2 浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应的反应热为负值 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0kJ/mol(燃烧热) | |
| B. | H2SO4(aq)+2NaOH (aq)═Na2SO4(aq)+2H2O (l)△H=-114.6kJ/mol(中和热) | |
| C. | S (s)+O2(g)═SO2 (g)△H=-296.8kJ/mol(燃烧热) | |
| D. | 2NO2═O2+2NO△H=+116.2kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
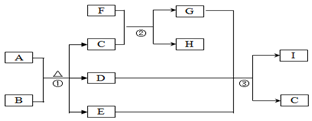 有关物质的转化关系如图所示(部分生成物与反应条件已略去).A是常见的非金属固体单质,F是紫红色的金属单质,B、C是常见的强酸,D、G、I是常见的气体,D与I的组成元素相同,且D的相对分子质量比I的大16.E是最常见的无色液体.
有关物质的转化关系如图所示(部分生成物与反应条件已略去).A是常见的非金属固体单质,F是紫红色的金属单质,B、C是常见的强酸,D、G、I是常见的气体,D与I的组成元素相同,且D的相对分子质量比I的大16.E是最常见的无色液体. .
. 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com