
(14分)“氢能”将是未来最理想的新能源。
Ⅰ 在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 。
Ⅱ 氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g) CO2(g)+H2(g) △H<0。在850℃时,平衡常数K=1。
CO2(g)+H2(g) △H<0。在850℃时,平衡常数K=1。
(1)若升高温度至950℃,达到新平衡状态时K (填“>”、“<”或“=”)1。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 molCO、3.0mol H2O、1.0 molCO2和x mol H2,则:
①当x = 5.0时,上述平衡向 (填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
③若设x=5.0 mol和x=6.0 mol,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a (填“>”、“<”或“=”)b。
Ⅲ 海水淡化获得淡水的过程也可以产生氢气。下面是利用电渗析法处理海水获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:
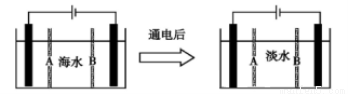
(1)阳离子交换膜是指______________ (填A或B)。
(2)写出通电后阳极的电极反应式:_________________________________________,在阴极区观察到的现象是:_________________________________________。
Ⅰ H2(g)+ 1/2O2(g)=H2O(l) △H=-285.8kJ/mol(2分)
Ⅱ (1)<(1分)(2) ①逆反应(2分)②0≤x<3或x<3(2分)③<(2分)
Ⅲ (1)B(1分) (2)2Cl--2e-═Cl2↑;出现白色沉淀
【解析】
试题分析:Ⅰ 在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则2g氢气即1mol氢气完全燃烧生成液态水时放出142.9kJ热量×2=285.8kJ。由于燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,则表示氢气燃烧热的热化学方程式为H2(g)+ 1/2O2(g)=H2O(l) △H=-285.8kJ/mol。
Ⅱ(1)正方应是放热反应,因此升高温度平衡向逆反应方向进行,则若升高温度至950℃,达到新平衡状态时K<1。
(2)①由于反应前后体积不变,则可以用物质的量表示浓度计算平衡常数。则当x = 5.0时,此时浓度商为 >1,因此反应向逆反应方向进行。
>1,因此反应向逆反应方向进行。
②若要使上述反应开始时向正反应方向进行,则 <1,解得x<3,因此x应满足的条件是0≤x<3。
<1,解得x<3,因此x应满足的条件是0≤x<3。
③增大一种生成物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,故平衡后氢气的体积分数还是大于原来的。
Ⅲ(1)阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜B和阴极相连,阴极是阳离子放电,所以隔膜B是阳离子交换膜。
(2)根据阳极是氯离子放电:2Cl--2e-═Cl2↑,阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大,和钙离子,镁离子形成沉淀。
考点:考查热化学方程式、平衡常数计算与应用以及电化学原理的应用


科目:高中化学 来源:2013-2014天津市第二学期期中检测高一化学试卷(解析版) 题型:选择题
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子。根据以上叙述,下列说法中正确的是
A.上述四种元素的原子半径大小为W<X<Y<Z
B. W与Y可形成既含极性共价键又含非极性共价键的化合物
C. W、X、Y、Z原子的核外最外层电子数的总和为20
D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市下学期期中考试高二化学试卷(解析版) 题型:选择题
要检验己烯中是否混有少量甲苯,正确的实验方法是
A.先加足量的酸性高锰酸钾溶液,然后再加入溴水
B.点燃这种液体,然后再观察火焰的颜色
C.先加足量溴水,然后再加入酸性高锰酸钾溶液
D.加入浓硫酸与浓硝酸后加热
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市南开区高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.25oC与60oC时,纯水的pH相等
B.CaCO3难溶于稀硫酸,也难溶于醋酸
C.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市南开区高三二模试卷理综化学试卷(解析版) 题型:选择题
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/LNaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)=0时,c(H+)=1×10-2mol/L
B.V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4- )
C.V(NaOH)=10 mL时,c(H+)=1×10-7mol/L
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- )
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高三毕业班联考二理综化学试卷(解析版) 题型:选择题
溶液X中可能含有K+、Mg2+、Al3+、AlO、SiO、CO、SO、SO中的若干种离子。某同学对该溶液进行了如下实验:
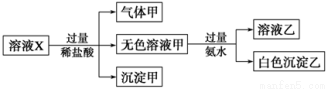
下列判断正确的是
A.气体甲一定是纯净物
B.沉淀乙为Mg(OH)2
C.沉淀甲是硅酸和硅酸镁的混合物
D.溶液X中一定存在K+、AlO 和SiO
和SiO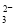 离子
离子
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市东丽区第一学期期末质量监测高一年级化学试卷(解析版) 题型:简答题
(12分) 实验室可用干燥纯净的氨还原氧化铜来制取氮气。根据下列装置图(部分夹持装置略去)回答有关问题:
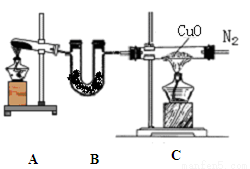
(1)装置B中盛放的药品是 。
(2)写出装置A中反应的化学方程式______ 。
(3)写出装置C中反应的化学方程式_________ ,该反应中的氧化剂是 。
(4)收集到的氮气中除了含有少量水蒸气外,还可能含有另外一种气体,确定是否含有该气体的实验方法是 ,实验室收集氮气的方法是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市东丽区第一学期期末质量监测高一年级化学试卷(解析版) 题型:选择题
下列实验方案设计中,可行的是
A.用萃取的方法可将汽油和煤油进行分离
B.加过量稀盐酸后过滤,可除去混在铜粉中的少量镁粉和铝粉
C.用溶解、过滤的方法可分离硝酸钾和氯化钠固体混合物
D.将混有氢气的氧气通过灼热的氧化铜,以除去其中的氢气
查看答案和解析>>
科目:高中化学 来源:2013-2014天津五区县高一下学期期末考试化学试卷(解析版) 题型:选择题
对于A2 + 3B2  2C的反应来说,以下化学反应速率的表示中,反应速率最快的是
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是
A.v (B2) = 0.8mol/ (L?s) B.v (A2) = 0.4mol/ (L?s)
C.v (C) = 0.6mol/ (L?s) D.v (B2) = 4.2mol/ (L?min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com