
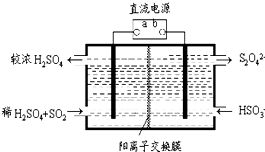
 氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.
氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.分析 (1)已知:①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),
②2NO(g)+Cl2(g)?2ClNO(g),
根据盖斯定律①×2-②可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数为①的平衡常数平方与②的商;
(2)测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则△n(ClNO)=7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,由方程式计算参加反应NO物质的量,进而计算NO的转化率;
正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应(Ⅱ)在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动;
(3)NO2-的水解常数K=$\frac{c(HN{O}_{2})×c(O{H}^{-})}{c(N{{O}_{2}}^{-})}$,据此计算混合溶液中c(NO2-)和c(HNO2)的比值;
(4)阳极发生氧化反应,阳极上是二氧化硫被氧化为硫酸根;
阴极排出的溶液为S2O42-,与二氧化氮发生转化为无害气体,同时有SO42-生成,无害气体为氮气;
(5)计算浓度积Qc=c(Ba2+)×c(SO32-),与溶度积Ksp(BaSO3)比较判断.
解答 解:(1)已知:①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),
②2NO(g)+Cl2(g)?2ClNO(g),
根据盖斯定律①×2-②可得:4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g),则该反应平衡常数K=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$,
故答案为:$\frac{{{K}_{1}}^{2}}{{K}_{2}}$;
(2)测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则△n(ClNO)=7.5×10-3mol•L-1•min-1×10min×2L=0.15mol,由方程式可知参加反应NO物质的量为0.15mol,则NO的转化率为$\frac{0.15mol}{0.2mol}$×100%=75%;
正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应(Ⅱ)在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,NO转化率增大,故转化率α2>α1,
故答案为:75%;>;
(3)常温下某NaNO2和 HNO2 混合溶液的PH为5,则溶液中c(OH-)=10-9mol/L,NO2-的水解常数K=$\frac{c(HN{O}_{2})×c(O{H}^{-})}{c(N{{O}_{2}}^{-})}$=2×10-11mol•L-1,则混合溶液中c(NO2-)和c(HNO2)的比值为$\frac{c(O{H}^{-})}{2×1{0}^{-11}}$=50,
故答案为:50;
(4)阳极发生氧化反应,阳极上是二氧化硫被氧化为硫酸根,阳极电极反应式为:SO2+2H2O-2e-=SO42-+4H+;
阴极排出的溶液为S2O42-,与二氧化氮发生转化为无害气体,同时有SO42-生成,无害气体为氮气,反应离子方程式为:4S2O42-+6NO2+8OH-═8SO42-+3N2+4H2O,
故答案为:SO2+2H2O-2e-=SO42-+4H+;4S2O42-+6NO2+8OH-═8SO42-+3N2+4H2O;
(5)若溶液中c(Ba2+)=0.1 mol•L-1,c(SO32-)=6.3×10-8mol•L-1,其浓度积Q=c(Ba2+)×c(SO32-)=0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7,故不能析出BaSO3沉淀,
故答案为:不能;若溶液中c(Ba2+)=0.1 mol•L-1,c(SO32-)=6,3×10-8mol•L-1,其浓度积Q=c(Ba2+)×c(SO32-)<0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7.
点评 本题考查化学平衡计算与影响因素、化学平衡常数、水解常数、电解原理应用、溶度积应用等,侧重考查学生分析计算能力,需要学生具备扎实的基础与灵活应用能力,难度中等.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:解答题
| 操作步骤 | 现象 |
| 步骤1:向20mL0.05mol•L-1AgNO3溶液中加入20mL0.05mol•L-1KSCN溶液,充分反应后过滤 | 出现白色沉淀 |
| 步骤2:向滤液中滴加少量2mol•L-1Fe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2所得溶液中,加入少量3mol•L-1AgNO3溶液 | 现象a |
| 步骤4:取步骤1所得少量滤渣加入到适量的3mol•L-1KI溶液中 | 出现黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | A2B3是三氧化二铝 | B. | A3+与B2-最外层上的电子数相同 | ||
| C. | A是第2周期第ⅢA族的元素 | D. | B是第3周期第ⅥA族的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④⑤ | C. | ①②④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ③④⑤ | C. | ②③⑤ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液中H+剩余 1.8mol | |
| B. | 由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 | |
| C. | 反应后产生13.44L H2(标准状况) | |
| D. | 反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Li3N | NaNH2 | SiBr4 | Mg2Si |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ”标志的是c(选填字母).
”标志的是c(选填字母).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com