
【题目】(1)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
①黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,氧化产物为___________,若有3mol FeS2参加反应,转移_____mol电子。
6SO2+Fe3O4,氧化产物为___________,若有3mol FeS2参加反应,转移_____mol电子。
②与明矾相似,硫酸铁也可用作净水剂,其原理为:___________(用离子方程式表示)。
③FeC13与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_________________。
(2)己知:S2O32-具有较强的还原性,实验室可用I-测定K2S2O8样品的纯度,反应方程式为:
S2O82-+2I-=2SO42-+I2 ① I2+2S2O32-=2I-+S4O62- ②
S2O82-、S4O62-、I2氧化性强弱顺序_______。
(3)己知溶液中,还原性为HSO3->I-,氧化性为IO3->I2>SO42-。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。
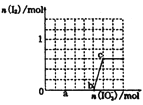
①a点处的还原产物是:________(填离子符号);
b点→c点反应的离子方程式是________。
②当溶液中的I-为0.5mol时、加入的KIO3可能是_________mol。
【答案】(1) ①SO2 Fe3O4;32;②Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ ;③2Fe3++2I-=2Fe2++I2;
Fe(OH)3(胶体)+3H+ ;③2Fe3++2I-=2Fe2++I2;
(2) S2O82-> I2>S4O62-;(3) ①I-;3HSO3-+IO3-=3SO42-+I-+3H+;②0.5或1.1。
【解析】
试题分析:(1)①在反应3FeS2+8O2![]() 6SO2+Fe3O4中,FeS2中Fe、S元素的化合价升高,失去电子,被氧化,O2中的O元素的化合价降低,被还原,所以氧化产物为SO2 Fe3O4;3molFeS2参加反应,由O元素的化合价变化可知,转移的电子为8mol×2×(2-0)=32mol;②硫酸铁是强酸弱碱,在溶液中Fe3+发生水解反应:Fe3++3H2O
6SO2+Fe3O4中,FeS2中Fe、S元素的化合价升高,失去电子,被氧化,O2中的O元素的化合价降低,被还原,所以氧化产物为SO2 Fe3O4;3molFeS2参加反应,由O元素的化合价变化可知,转移的电子为8mol×2×(2-0)=32mol;②硫酸铁是强酸弱碱,在溶液中Fe3+发生水解反应:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,产生的Fe(OH)3胶体表面积大,吸附力强,可以吸附水中悬浮的固体,使之形成沉淀,从而可以使水净化,作水的净水剂;③FeC13与氢碘酸反应时可生成棕色物质是I2,根据电子守恒、电荷守恒及原子守恒,可得该反应的离子方程式为2Fe3++2I-=2Fe2++I2;(2)根据物质的氧化性:氧化剂>氧化产物,由S2O82-+2I-=2SO42-+I2可知氧化性:S2O82-> I2;由I2+2S2O32-=2I-+S4O62-可知氧化性:I2> S4O62-.所以氧化性:S2O82-> I2>S4O62-;(3)HSO3->I-,在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,首先发生反应:3HSO3-+IO3-=3SO42-+I-+3H+;HSO3-反应完毕,继续加入KIO3,由于氧化性IO3->I2,再发生反应:IO3-+6H+ +5I- =3H2O+3I2。①由图可知,a点没有生成碘,故发生反应3HSO3-+ IO3-=3SO42-+I-+3H+,反应中S元素化合价升高,还原剂是HSO3-,I元素的化合价降低,I元素被还原,所以此处的还原产物是I-,由图可知,b点到c点由于生成I2,故发生反应:IO3-+6H+ +5I- =3H2O+3I2。;②当溶液中的I-为0.5mol时,有两种情况:一是只发生反应3HSO3-+IO3-=3SO42-+I-+3H+,生成I-为0.5mol,根据碘元素守恒n(KIO3) =n(I-)=0.5mol;二是HSO3-反应完毕后,还发生IO3-+6H+ +5I- =3H2O+3I2,剩余I-为0.5mol,3molNaHSO3消耗1molKIO3、生成1molI-,故反应IO3-+6H+ +5I- =3H2O+3I2中消耗的I-为1mol-0.5mol=0.5mol,消耗KIO3的物质的量为0.5mol×1/5=0.1mol,故共加入的KIO3为1mol+0.1mol=1.1mol,故答案为:0.5或1.1。
Fe(OH)3(胶体)+3H+,产生的Fe(OH)3胶体表面积大,吸附力强,可以吸附水中悬浮的固体,使之形成沉淀,从而可以使水净化,作水的净水剂;③FeC13与氢碘酸反应时可生成棕色物质是I2,根据电子守恒、电荷守恒及原子守恒,可得该反应的离子方程式为2Fe3++2I-=2Fe2++I2;(2)根据物质的氧化性:氧化剂>氧化产物,由S2O82-+2I-=2SO42-+I2可知氧化性:S2O82-> I2;由I2+2S2O32-=2I-+S4O62-可知氧化性:I2> S4O62-.所以氧化性:S2O82-> I2>S4O62-;(3)HSO3->I-,在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,首先发生反应:3HSO3-+IO3-=3SO42-+I-+3H+;HSO3-反应完毕,继续加入KIO3,由于氧化性IO3->I2,再发生反应:IO3-+6H+ +5I- =3H2O+3I2。①由图可知,a点没有生成碘,故发生反应3HSO3-+ IO3-=3SO42-+I-+3H+,反应中S元素化合价升高,还原剂是HSO3-,I元素的化合价降低,I元素被还原,所以此处的还原产物是I-,由图可知,b点到c点由于生成I2,故发生反应:IO3-+6H+ +5I- =3H2O+3I2。;②当溶液中的I-为0.5mol时,有两种情况:一是只发生反应3HSO3-+IO3-=3SO42-+I-+3H+,生成I-为0.5mol,根据碘元素守恒n(KIO3) =n(I-)=0.5mol;二是HSO3-反应完毕后,还发生IO3-+6H+ +5I- =3H2O+3I2,剩余I-为0.5mol,3molNaHSO3消耗1molKIO3、生成1molI-,故反应IO3-+6H+ +5I- =3H2O+3I2中消耗的I-为1mol-0.5mol=0.5mol,消耗KIO3的物质的量为0.5mol×1/5=0.1mol,故共加入的KIO3为1mol+0.1mol=1.1mol,故答案为:0.5或1.1。


科目:高中化学 来源: 题型:
【题目】NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
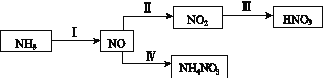
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是______________。
(2)Ⅱ中,2NO(g)+O2(g)![]() 2NO2(g)。在其他条件相
2NO2(g)。在其他条件相
同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。
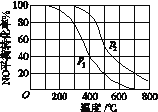
①比较p1、p2的大小关系:p1________p2(填“<”,“>”或“=”)
②随温度升高,该反应平衡常数变化的趋势是________(填“增大”,“减小”或“不变”)。
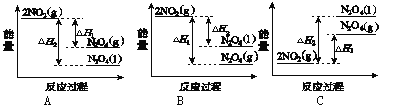
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g)![]() N2O4(g) ΔH12NO2(g)
N2O4(g) ΔH12NO2(g)![]() N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母)________。
②N2O4与O2、H2O化合的化学方程式是____________________。
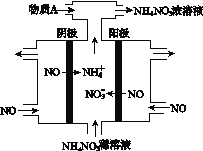
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。为使电解产物全部转化为NH4NO3,需补充A。A是______,说明理由:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或记录正确的是
A. 常温常压下测得1 mol N2的质量为28 g
B. 用量筒测得排水法收集制得的氢气的体积为50.28 mL
C. 用两只250 mL的容量瓶配制0.1 mol·L-1500 mL的NaOH溶液
D. 用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验需要0.80 mol·L-1 NaOH溶液475 mL和0.40 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
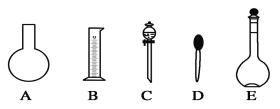
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)下列操作中,不能用容量瓶实现的有______________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.量取一定体积的液体
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.贮存溶液
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为_______g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度______(填”大于”、“等于”或“小于”,下同)0.8 mol·L-1。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度______0.8 mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL量筒,选用________mL量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物。它可由氟碳酸铈精矿经如下流程制得。
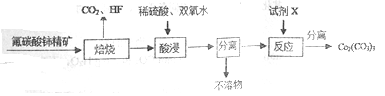
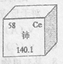
(1)如图是一种稀土元素铈(Ce)在元素周期表中的信息示意图。则铈原子的质子数是______,氟碳酸铈的化学式为CeFCO3,该化合物中,Ce的化合价为_____________;
(2)焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为______________;
(3)试剂X______________;
(4)已知298K时,Ksp[Ce(OH)4]=1×10-29,Ce(OH)4的溶度积表达式为Ksp=______________;为了使溶液中Ce4+沉淀完全,需调节pH为________以上;
(5)取某Ce(OH)4产品1.00g(质量分数为97%),加硫酸溶解后,用0.1000molL-1的FeSO4溶液滴定至终点(铈被还原成Ce3+)则需要滴加标准溶液的体积____________mL,若用硫酸酸化后改用0.1000molL-1
的FeCl2溶液滴定产品从而测定Ce(OH)4产品的质量分数,其它操作都正确,则测定的Ce(OH)4产品的质量分数__________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一些茶叶的包装盒中有一个小袋,将小袋打开可看到灰黑色粉末,其中有的已变成棕褐色。将这种灰黑色粉末投入稀盐酸后,取其上层清液并加几滴氯水,再滴加KSCN溶液,马上出现红色。以下结论不正确的是 ( )
A.该灰黑色粉末作抗氧化剂
B.该灰黑色粉末不可食用
C.小袋中原来装有铁粉
D.小袋中原来装有氧化铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有关物质的叙述正确的是( )
①酸性氧化物肯定是非金属氧化物 ②不能跟酸反应的氧化物一定能跟碱反应 ③碱性氧化物肯定是金属氧化物 ④分散系一定是混合物 ⑤浊液均可用过滤的方法分离
A.①③ B.③④ C.②④ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用自由电子与金属离子的碰撞中有能量传递来解释的物理性质是( )
A.金属是热的良导体
B.金属是电的良导体
C.金属有良好的延展性
D.有金属光泽,不透明
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com