
| A. | 在镀件上电镀锌,用锌作阳极 | |
| B. | 电解法精炼粗铜,用纯铜作阴极 | |
| C. | 电解饱和食盐水制氯气,用涂镍碳钢网作阴极 | |
| D. | 电解熔融的氧化铝制取金属铝,用铁作阳极 |
分析 A、依据电镀原理分析,镀层金属做阳极;
B、依据电解精炼铜原理分析,粗铜做阳极,纯铜做阴极;
C、电解饱和食盐水,阳极材料为石墨,溶液中氯离子失电子生成氯气;
D、电解原理分析,铁做阳极失电子溶解;
解答 解:A、依据电镀原理分析,镀层金属做阳极,在镀件上电镀锌,用锌作阳极,故A正确;
B、依据电解精炼铜原理分析,粗铜做阳极,纯铜做阴极,故B正确;
C、电解饱和食盐水,阳极材料为石墨,溶液中氯离子失电子生成氯气,用涂镍碳钢网作阴极,故C正确;
D、电解原理分析,铁做阳极失电子溶解不符合生产实际,电解熔融的氧化铝制取金属铝,用石墨作阳极,故D错误;
故选D.
点评 本题考查了电解原理的理解和应用,主要是电解精炼铜、电镀、氯碱工业原理分析判断,题目较简单.


科目:高中化学 来源: 题型:多选题
| A. | 准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol•L-1的NaOH标准溶液 | |
| B. | 催化剂可以加快化学反应速率但不能改变化学反应的焓变 | |
| C. | 100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 | |
| D. | 对于反应2SO2(g)+O2(g)?2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
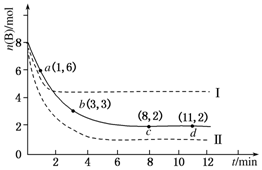
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、SO42-、NO3- | B. | K+、Na+、SO42-、Ba2+ | ||
| C. | K+、MnO4-、NH4+、Cl- | D. | Cu2+、K+、HCO3-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外小组利用下列装置,对浓硫酸与乙醇反应的可能产物进行了如下探究.
某课外小组利用下列装置,对浓硫酸与乙醇反应的可能产物进行了如下探究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
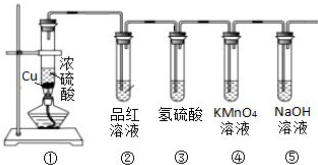
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为296×10-3mol•L-1•s-1 | |
| B. | 该温度下的反应平衡时N2O5的转化率为29.6% | |
| C. | 1000s后,其它条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,则c(N2O5)<5.00mol/L | |
| D. | 反应达平衡后,其他条件不变,升高温度平衡常数将增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com