
| A. | $\frac{({C}_{1}+{C}_{2}){ρ}_{3}}{100({ρ}_{1}+{ρ}_{2})}$ | |
| B. | <“m“:math xmlns:dsi='http://www.dessci.com/uri/2003/MathML'dsi:zoomscale='150'dsi:_mathzoomed='1'style='CURSOR:pointer; DISPLAY:inline-block'>100(C1+C2)ρ3ρ1+ρ2$\frac{100({C}_{1}+{C}_{2}){ρ}_{3}}{{ρ}_{1}+{ρ}_{2}}$ | |
| C. | $\frac{({C}_{1}+{C}_{2}){ρ}_{3}}{100({ρ}_{1}+{ρ}_{2})}$ | |
| D. | $\frac{({C}_{1}+{C}_{2}){ρ}_{3}}{{ρ}_{1}+{ρ}_{2}}$ |
分析 设溶液体积都为1L,计算出两种硫酸溶液的质量,混合后的硫酸溶液质量为两种硫酸溶液的质量之和,再利用密度计算混合后的体积,根据混合后硫酸的物质的量为原两种硫酸溶液中硫酸的物质的量计算浓度.
解答 解:设溶液体积都为1L,则混合后硫酸溶液的质量为1000ml×ρ1g/ml+1000ml×ρ2g/ml=1000(ρ1+ρ2)g.
所以混合后的硫酸溶液的体积为$\frac{1000(ρ1+ρ2)g}{ρ3g/ml}$=1000×$\frac{ρ1+ρ2}{ρ3}$ml=$\frac{ρ1+ρ2}{ρ3}$L.
令混合后的物质的量浓度为c,则:
1L×C1 mol/L+1L×C2 mol/L=$\frac{ρ1+ρ2}{ρ3}$L×c
解得,c=$\frac{(C1+C2)ρ3}{ρ1+ρ2}$.
故选:D
点评 本题考查物质的量浓度计算,属于字母型计算,增大计算难度,注意对公式的理解与灵活应用,掌握物质的量浓度与质量分数关系,可以利用定义式计算,难度中等.


科目:高中化学 来源: 题型:解答题
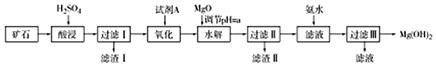
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 7.6 | 1.9 | 3.4 | 9.1 |
| 完全沉淀的pH | 9.6 | 3.2 | 4.7 | 11.1 |
| 物质 | 价格(元•吨-1) |
| 漂液(含25.2% NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;化合物BA4的电子式为
;化合物BA4的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 皮肤上不慎沾到少量浓硫酸,应先用干抹布擦拭、再用大量水冲洗 | |
| B. | 检验HCl气体中是否混有Cl2,可将气体通入硝酸银溶液 | |
| C. | 验证某气体中含CO2、SO2,可依次通入品红溶液、饱和NaHCO3溶液、澄清石灰水 | |
| D. | 检验Fe2(SO4)3溶液中是否含有Fe2+,可用KMnO4酸性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 核磁共振氢谱数据在推理A的结构式时用处不大 | |
| B. | A的结构式可表示为C6H5-COOH | |
| C. | 符合题中A分子结构特征的有机物有2种 | |
| D. | 碥定A的分子结构还需要实验数据 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com