
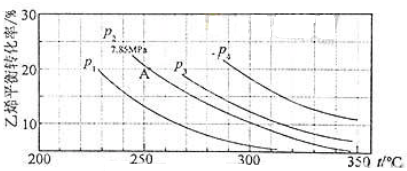
| 0.2 |
| 0.8+0.8+0.2 |
| 1 |
| 9 |
| 0.8 |
| 0.8+0.8+0.2 |
| 4 |
| 9 |
| 1 |
| 9 |
| 4 |
| 9 |
| p(C2H5OH) |
| p(C2H4)?p(H2O) |
| 0.87MPa |
| 3.49MPa×3.49MPa |


科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 用铂丝蘸取某待测液在酒精灯外焰上灼烧 | 火焰呈黄色 | 待测液不含钾元素 |
| B | AgBr沉淀中滴入KCl溶液 | 有白色沉淀出现 | AgCl比AgBr更难溶 |
| C | 铁丝插入稀硝酸中 | 有无色气体产生 | 生成氢气 |
| D | 向NaCN溶液中滴加无色酚酞试液 | 溶液变红 | HCN是弱电解质 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
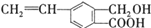 ,关于有机物M的说法正确的是( )
,关于有机物M的说法正确的是( )| A、有机物M的分子式为C10H12O3 |
| B、1mol Na2CO3最多能消耗1mol有机物M |
| C、1mol M和足量金属钠反应生成22.4L气体 |
| D、有机物M能发生取代、氧化和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相 关 信 息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z是地壳中含量最高的金属元素 |
| W | W的一种核素的质量数为28,中子数为14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
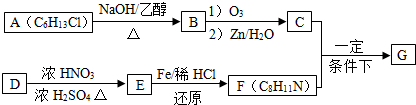
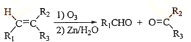

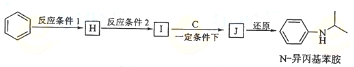
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
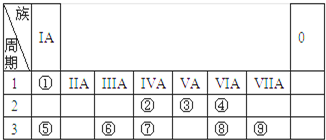
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
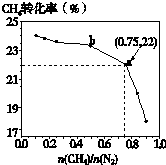 已知:3CH4(g)+2N2(g)
已知:3CH4(g)+2N2(g)| 700℃ |
| 催化剂 |
| n(CH4) |
| n(N2) |
A、
| ||
B、
| ||
| C、b点对应的平衡常数比a点的大 | ||
| D、a点对应的NH3的体积分数约为26% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com