
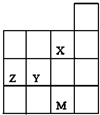
| A、Y、Z的最高价氧化物的水化物酸性为Y<Z |
| B、M的最外层电子数比Z大10 |
| C、X、M的气态氢化物的稳定性M>X |
| D、X、Y形成简单离子的最外层电子均满足8e-稳定结构 |


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
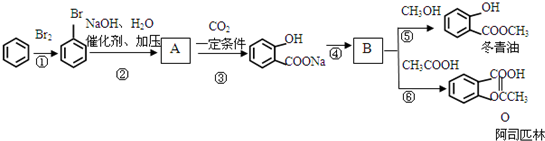
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
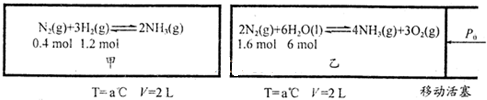
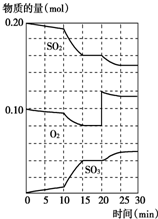 600℃时,在一固定容积的密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0.反应过程中SO2、O2、SO3物质的量的变化如图,下列说法错误的是( )
600℃时,在一固定容积的密闭容器中,将二氧化硫和氧气混合发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0.反应过程中SO2、O2、SO3物质的量的变化如图,下列说法错误的是( )| A、反应从开始到第一次平衡时,二氧化硫的转化率为20% |
| B、10~15 min和20~25min相比,前者的化学反应速率大 |
| C、反应进行至20min时,曲线发生变化是因为通入了氧气 |
| D、反应进行到10min~15 min的曲线变化原因一定是增大了压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 等级 | 优等品 | 一等品 | 合格品 |
| Na2CO3含量 | ≥99.2 | ≥98.8 | ≥98.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
物质 T/℃n/mol | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.10 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com