
| A. | 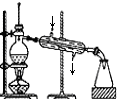 海水蒸馏得到淡水 | |
| B. | 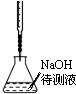 中和滴定 | |
| C. | 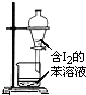 苯萃取碘水中I2,分出水层后的操作 | |
| D. | 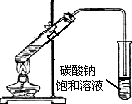 制备乙酸乙酯 |
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:解答题
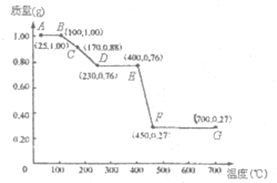 如图是1.00g MgC2O4•nH2O晶体放在坩埚里从25℃徐徐加热至700℃时,所得同体产物的质量(m)随温度(t)变化的关系曲线.(已知100℃以上才会逐渐失去结晶水,并约在230℃时完全失去结晶水)
如图是1.00g MgC2O4•nH2O晶体放在坩埚里从25℃徐徐加热至700℃时,所得同体产物的质量(m)随温度(t)变化的关系曲线.(已知100℃以上才会逐渐失去结晶水,并约在230℃时完全失去结晶水)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3↓+3H+ | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,正极反应式为:Cu-2e-═Cu2+ | |
| D. | NaHS水解:HS-+H2O?H3O++S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
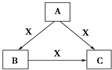 A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )| A. | 若X为O2,则A可为硫化氢 | |
| B. | 若X为KOH溶液,则A可为AlCl3 | |
| C. | 若X为Cl2,则C可为FeCl3 | |
| D. | 若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4•5H2O)、无水AlCl3和铁红的过程如图所示:
某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4•5H2O)、无水AlCl3和铁红的过程如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na>Si>Cl | B. | 还原性:Na>Mg>Al | ||
| C. | 稳定性:SiH4>H2S>HCl | D. | 酸性:H3PO4<H2SO4<HClO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com