
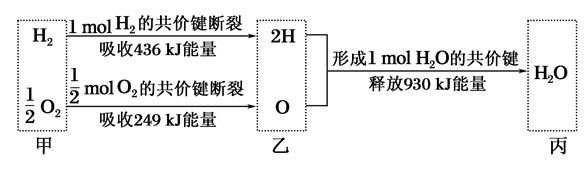
| A.H2O分解为H2与O2时放出热量 |
| B.生成1mol H2O时吸收热量245kJ |
| C.甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙 |
| D.氢气和氧气的总能量小于水的能量 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在离子化合物中不可能含有共价键 |
| B.在共价化合物中也可能含有离子键 |
| C.凡含有离子键的化合物一定是离子化合物 |
| D.由不同种非金属元素组成的化合物中只含有极性键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②⑤正确 | B.都不正确 |
| C.④正确,其他不正确 | D.仅①不正确 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Be2+中的质子和电子 |
B. 中的质子和中子 中的质子和中子 |
| C.NaHCO3中的阳离子和阴离子 |
| D.Na2O2中的阴离子和阳离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应①中反应物所具有的总能量大于生成物所具有的总能量 |
| B.2N2 H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1000.3 kJ/mol |
| C.铂作电极,KOH溶液作电解质溶液,由反应②设计的燃料电池,其负极反应式为N2H4-4e-+4OH-=N2+4H2O |
| D.铂作电极,KOH溶液作电解质溶液,由反应②设计的燃料电池,工作一段时间后,KOH溶液的pH将增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com