
下列装置应用于实验室进行相关实验,能达到实验目的的是
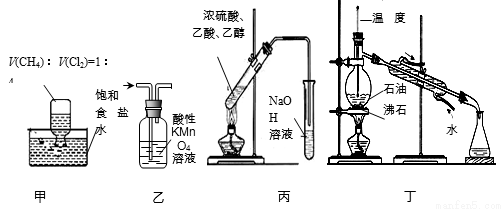
A.用装置甲在光照条件下验证甲烷与氯气的反应
B.用装置乙除去甲烷中少量的乙烯得纯净甲烷
C.用装置丙制取并收集乙酸乙酯
D.用装置丁分馏石油并收集60~150℃馏分
 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源:2015-2016学年江苏省高二下学期第二次月考化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.Al3+的结构示意图: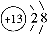
B.甲酸甲酯的结构简式:C2H4O2
C.醋酸的电离方程式:CH3COOH=CH3COO- + H+
D.中子数为145、质子数为94的钚(Pu)原子: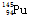
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二下学期期中考试化学试卷(解析版) 题型:选择题
已知拆开1mol H–H键, 1mol N≡N键分别需要吸收的能量为436kJ 、946kJ;形成1mol N–H键,会放出能量391kJ,在反应N2 + 3H2 2NH3中,每生成2mol NH3,
2NH3中,每生成2mol NH3,
A.放出92 kJ热量 B.吸收92 kJ热量
C.放出209kJ热量 D.吸收209kJ热量
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一6月月考化学试卷(解析版) 题型:填空题
(1) 已知提示: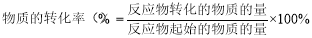
在2L的容器中进行下列可逆反应,各物质的有关数据如下:
aA (g) + bB (g)  2C(g)
2C(g)
起始物质的量浓度(mol/L): 1.5 1 0
2s末物质的量浓度(mol/L): 0.9 0.8 0.4
则:①该可逆反应的化学方程式可表示为 ;②0到2s用物质B来表示的反应速率为 ;③从反应开始到2s末,A的转化率为 ;
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是 。
A.vB(反应)= vC(生成)
B.容器内气体的总压强保持不变
C.容器内气体的密度不变
D.vA︰vB︰vC=3︰2︰2
E.容器内气体C的物质的量分数保持不变
(2) ①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是:2Zn+O2=2ZnO。则该电池的负极材料是 ;当导线中有1 mol电子通过时,理论上消耗的O2在标准状况下的体积是 。
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如下,该燃料电池工作时,外电路中电子的流动方向是从电极 到电极 ;电池的总反应为 。
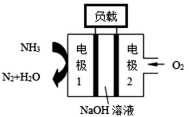
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一6月月考化学试卷(解析版) 题型:选择题
在探究乙醇的有关实验中,得出的结论正确的是
选项 | 实验步骤及现象 | 实验结论 |
A. | 在酒精试样中加入少量CuSO4·5H2O,搅拌,试管底部有蓝色晶体 | 酒精试样中一定含有水 |
B. | 在乙醇燃烧火焰上方罩一冷的干燥烧杯,内壁有水珠出现,另罩一内壁涂有澄清石灰水的烧杯,内壁出现白色沉淀 | 乙醇由C、H、O三种元素组成 |
C. | 在0.01mol金属钠中加入过量的乙醇充分反应,收集到标准状况下气体112mL | 乙醇分子中有1个氢原子与氧原子相连,其余与碳原子相连 |
D. | 将灼热后表面变黑的螺旋状铜丝伸入约50℃的乙醇中,铜丝能保持红热一段时间 | 乙醇催化氧化反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一6月月考化学试卷(解析版) 题型:选择题
过氧化氢一定条件下可发生分【解析】
2H2O2(l)=2H2O(l)+O2(g),其能量变化如下图所示,下列说法正确的是

A.该分解反应为吸热反应
B.2molH2O2具有的能量小于2molH2O和1molO2所具有的总能量
C.加入MnO2或FeCl3均可提高该分解反应的速率
D.其他条件相同时,H2O2溶液的浓度越大,其分解速率越慢
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一6月月考化学试卷(解析版) 题型:选择题
目前工业上获得大量乙烯、丙烯的方法是
A.石油分馏 B.石油分馏产品裂解
C.煤的干馏 D.重油催化裂化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二6月月考化学试卷(解析版) 题型:选择题
钛是航空、军工、电力等领域的重要原料。工业上用钛酸亚铁(FeTiO3)冶炼钛(Ti)的过程是:①2FeTiO3+6C+7Cl2 2TiCl4+2FeCl3+6CO
2TiCl4+2FeCl3+6CO
②在氩气环境中,2Mg+TiCl4 Ti+2MgCl2
Ti+2MgCl2
下列判断不正确的是( )
A.反应②属于置换反应
B.反应②中氯化物的总质量保持不变
C.反应①、②中钛元素的化合价都改变
D.反应②中,氩气只作为保护气并不参加反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西宾阳县宾阳中学高二5月月考化学试卷(解析版) 题型:填空题
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数( 25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是__________;
②体积相同、c(H+)相同的三种酸溶液①HCOOH;②HCN;③H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号) _____________;
③向 NaCN溶液通入少量CO2反应的化学方程式是_______________________________;
(2)①一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是________________;此时c(HCN)/c(CN-)=________________。
②常温下,NaCN与过氧化氢溶液反应,生成NaHCO3和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是_____________________________。
(3)已知CaCO3的KSp=2.8×l0- 9,现将浓度为2×l0-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为____________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com