
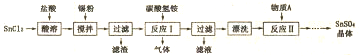
分析 SnCl2能水解生成碱式氯化亚锡,用盐酸溶解,防止其水解,在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+,加入锡粉主要是防止在溶解时被空气中氧气氧化,过滤出锡粉,得到SnCl2溶液,(4)中反应Ⅰ与碳酸氢铵反应生成SnO,Sn元素化合价未变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,发生反应:SnCl2+2NH4HCO3═SnO↓+2CO2↑+2NH4Cl+H2O,温度较高时碳酸氢铵会分解,需要控制在75℃左右.过滤得到SnO,洗涤表面附着的NH4Cl等,进行洗涤,再利用SnO与硫酸反应得到SnSO4溶液,经过蒸发浓缩、冷却结晶等操作得到SnSO4是晶体.
(1)锡原子的核电荷数为50,与碳元素属于同一主族,处于ⅣA族,根据原子序数减各周期容纳元素种数确定所在的周期;
(2)由信息可知,SnCl2易水解生成碱式氯化亚锡,加入盐酸,抑制Sn2+水解;
(3)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
(4)反应Ⅰ得到沉淀是SnO,Sn元素化合价未变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳;由于碳酸氢铵容易分解,需要控制在75℃左右;
(5)SnO表面附着的NH4Cl等,用AgNO3溶液检验最后一次洗涤液是否含有氯离子,判断是否洗涤干净;
(6)潮湿环境中,Sn与Cu构成原电池,Sn作为负极,保护正极Cu不被氧化.
解答 解:SnCl2能水解生成碱式氯化亚锡,用盐酸溶解,防止其水解,在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+,加入锡粉主要是防止在溶解时被空气中氧气氧化,过滤出锡粉,得到SnCl2溶液,(4)中反应Ⅰ与碳酸氢铵反应生成SnO,Sn元素化合价未变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,发生反应:SnCl2+2NH4HCO3═SnO↓+2CO2↑+2NH4Cl+H2O,温度较高时碳酸氢铵会分解,需要控制在75℃左右.过滤得到SnO,洗涤表面附着的NH4Cl等,进行洗涤,再利用SnO与硫酸反应得到SnSO4溶液,经过蒸发浓缩、冷却结晶等操作得到SnSO4是晶体.
(1)锡元素与碳元素属于同一主族,处于ⅣA族,原子核电荷数为50,则:50-2-8-8-18=14,故Sn处于第五周期,则在周期表中的位置为:第五周期第ⅣA族,
故答案为:五;
(2)由信息可知,SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解,
故答案为:SnCl2+H2O?Sn(OH)Cl+HCl;
(3)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还除去酸溶时产生的少量Sn4+、防止Sn2+被氧化,
故答案为:除去酸溶时产生的少量Sn4+、防止Sn2+被氧化;
(4)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,反应方程式为:SnCl2+2NH4HCO3═SnO↓+2CO2↑+2NH4Cl+H2O,温度较高时碳酸氢铵会分解,该反应的温度需要控制在75℃左右,
故答案为:SnCl2+2NH4HCO3═SnO↓+2CO2↑+2NH4Cl+H2O;温度较高时碳酸氢铵会分解;
(5)SnO表面附着的NH4Cl等,检验沉淀已经“漂洗”干净的方法:取少量最后一次洗涤液于试管中,滴入几滴AgNO3溶液,若无白色沉淀生成,则说明沉淀已洗涤干净;
A与SnO反应得到SnSO4溶液,故A为硫酸,
故答案为:取少量最后一次洗涤液于试管中,滴入几滴AgNO3溶液,若无白色沉淀生成,则说明沉淀已洗涤干净;硫酸;
(6)潮湿环境中,Sn与Cu构成原电池,Sn作为负极,保护正极Cu不被氧化,故即使锡层破损也能防止形成铜绿,
故答案为:潮湿环境中,Sn与Cu构成原电池,Sn作为负极,保护正极Cu不被氧化.
点评 本题考查制备实验方案,涉及对工艺流程的理解、对操作的分析评价、物质的分离提纯、金属腐蚀与防护、阅读题目获取信息的能力等,是对学生综合能力的考查,难度中等.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验结论 |
(1)A的质谱图如下: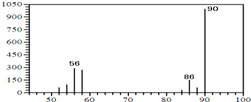 | (1)证明A的相对分子质量为90. |
| (2)将此9.0g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4g和13.2g. | (2)证明A的分子式为: C3H6O3. |
| (3)另取两份9.0g A分置于不同的试管中.往其中一份A中加入足量的NaHCO3粉末充分反应,生成2.24 L CO2(标准状况). 往另一份A中加入足量金属钠充分反应,生成2.24 L H2(标准状况). | (3)证明A的分子中含有羧基和羟基官能团. |
(4)A的核磁共振氢谱如图: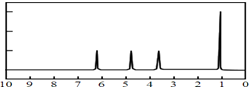 | (4)A的结构简式为: . . |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体扩散速率与扩散面积成正比 | |
| B. | 气体扩散速率与气体溶解度和分子量成正比 | |
| C. | 气体扩散速率与分压差成正比 | |
| D. | 气体扩散速率与温度成正比 | |
| E. | 气体扩散速率与扩散距离成反比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 与
与
 与
与
 与
与
 与
与
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测试时间段 | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
| 序号 | 二氧化硫的性质 | 主要操作和现象 | 化学方程式 |
| ① | 将二氧化硫通入装有品红溶液的 试管中,品红由红色变为无色 | ||
| ② | 将二氧化硫与硫化氢气体混合,出现 黄色固体. | SO2+2H2S=3S+2H2O | |
| ③ | 将二氧化硫通入装有新制氯水的试管中,氯水由浅黄绿色变为无色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com