
【题目】阿伏加德罗是意大利化学家(1776.08.09-1856.07.09),曾开业当律师,24岁后弃法从理,十分勤奋,终成一代化学大师。为了纪念他,人们把1 mol某种微粒集合体所含有的粒子个数,称为阿伏加德罗常数,用N![]() 表示。下列说法或表示中不正确的是
表示。下列说法或表示中不正确的是

A.科学上规定含有阿伏加德罗常数个粒子的任何微粒集合体都为1 mol
B.在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子转移的数目为5NA
C.60 克的乙酸和葡萄糖混合物充分燃烧消耗2NA个O2
D.6.02×1023mol-1 叫做阿伏加德罗常数
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.(CH3)3CCH2(CH3)C=CH2的名称为:2,2,4-三甲基-4-戊烯
B.![]() 在一定条件下可以发生缩聚反应生成高分子化合物
在一定条件下可以发生缩聚反应生成高分子化合物
C.1mol 有机物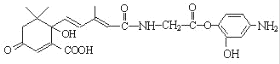 与 NaOH 溶液反应,最多消耗 6molNaOH
与 NaOH 溶液反应,最多消耗 6molNaOH
D.用氢氧化钠溶液可以除去乙酸乙酯中混有的乙酸、乙醇杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
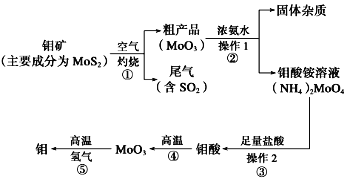
(1)写出在高温下发生反应①的化学方程式______________________________________________
(2)生产中用足量的浓氨水吸收反应①的尾气合成肥料,写出该反应的离子方程式:________________________________
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有_______________________
(4)某同学利用下图所示装置来制备氢气,利用氢气还原三氧化钼,根据要求回答问题:
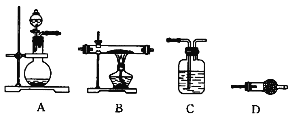
① 请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是___________
② 在烧瓶A中加入少量硫酸铜的目的是____________________________
③ 两次使用D装置,其中所盛的药品依次是____________________、______________________
(5)工业上制备还原性气体CO和H2的反应原理为CO2 + CH4![]() 2CO + 2H2 CH4 + H2O
2CO + 2H2 CH4 + H2O![]() CO + 3H2,含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为________________ (保留两位小数,钼的相对原子质量为96)
CO + 3H2,含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为________________ (保留两位小数,钼的相对原子质量为96)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2一氧代环戊羧酸乙酯(K)是常见医药中间体,聚酯G是常见高分子材料,它们的合成路线如下图所示:
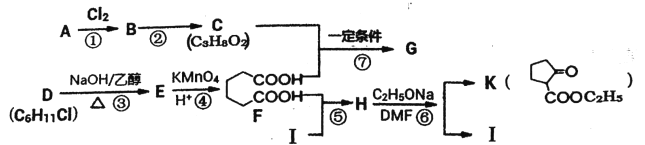
已知:①气态链烃A在标准状况下的密度为1.875g·L-1;
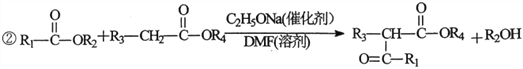
(1)B的名称为__________;E的结构简式为__________。
(2)下列有关K的说法正确的是__________。
A.易溶于水,难溶于CCl4
B.分子中五元环上碳原子均处于同一平面
C.能发生水解反应加成反应
D.1molK完全燃烧消耗9.5molO2
(3)⑥的反应类型为__________;⑦的化学方程式为__________
(4)与F官能团的种类和数目完全相同的同分异构体有__________种(不含立体结构),其中核磁共振氢谱为4组峰,且峰面积之比为1:2:3:4的是__________(写结构简式)。
(5)利用以上合成路线中的相关信息,请写出以乙醇为原料(其他无机试剂任选)制备![]()
的合成路线:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() 碳与适量水蒸气反应生成CO和H2,需吸收
碳与适量水蒸气反应生成CO和H2,需吸收![]() 热量,此反应的热化学方程式为_________________
热量,此反应的热化学方程式为_________________
(2)已知![]() ;
;![]()
![]() ;
;![]()
![]() ;
;![]()
常温下,取体积比4:1的甲烷和氢气的混合气体![]() (标准状况下),经完全燃烧后恢复至室温,则放出的热量为___________
(标准状况下),经完全燃烧后恢复至室温,则放出的热量为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,古代文献中记载了古代化学研究成果。下列叙述不正确的是
A.![]() 本草纲目
本草纲目![]() 中有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”的记载,“浣衣”过程中涉及水解反应
中有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”的记载,“浣衣”过程中涉及水解反应
B.![]() 本草衍义
本草衍义![]() 中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是干馏
中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是干馏
C.![]() 梦溪笔谈
梦溪笔谈![]() 中对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折”,“剂钢”指的是铁合金,硬度比纯铁大
中对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折”,“剂钢”指的是铁合金,硬度比纯铁大
D.![]() 淮南万毕术
淮南万毕术![]() 对湿法冶金术的记载:“曾青得铁则化为铜”,文中涉及置换反应
对湿法冶金术的记载:“曾青得铁则化为铜”,文中涉及置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱酸HA的电离常数![]() 。25℃时,有关弱酸的电离常数如下:
。25℃时,有关弱酸的电离常数如下:
弱酸化学式 | HCOOH | ②CH3COOH | C6H5OH | ④H2A |
电离常数 | 1.810-4 | 1.810-5 | 1.310-10 | K1=4.310-7,K2=5.610-11 |
⑴四种酸的酸性由强到弱的顺序是________________(用序号填空)。
⑵向0.1 mol/L CH3COOH溶液中滴加NaOH至溶液中![]() 时,此时溶液的pH=________。
时,此时溶液的pH=________。
⑶当H2A与NaOH溶液1:1混合溶液显________性(选填“酸、中、碱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾溶液中存在如下平衡:(1)Cr2O72-+H2O![]() 2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,发生反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正确的是
2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,发生反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正确的是
A. 向K2Cr2O7溶液加入几滴浓NaOH溶液,溶液由黄色变成橙黄
B. 氧化性:Cr2O72->Fe3+
C. CrO42-和Fe2+在酸性溶液中能大量共存
D. 向K2Cr2O7溶液中加水稀释,反应(1)平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同一周期相邻的A、B、C三种元素,都是短周期元素,A的最高价氧化物的化学式是A2O,11.6 g B的氢氧化物恰好能与200 mL 2 mol/L盐酸完全反应,B原子核中质子数与中子数相等。回答以下问题:
(1)B的相对原子质量是多少?原子序数是多少?_____________
(2)A和C各是什么元素?_____________
(3)A、B、C的单质各1 mol分别与足量的稀硫酸反应,产生H2最多的是哪一种单质?该单质产生H2的体积在标准状况下是多少?_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com