
| A. | FeCl3 | B. | NH3 | C. | NH4HCO3 | D. | Cl2 |
分析 能导电的物质中含有自由电子或自由移动的阴阳离子;非电解质是相对于电解质而言的一个概念.
电解质是指:在水溶液中或熔融状态下能够导电的化合物;电解质水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;
非电解质是指:在熔融状态和水溶液中都不能导电的化合物;也就是说,非电解质在熔融状态和水溶液中自身都不能离解出自由移动的离子;
单质、混合物,既不是电解质也不是非电解质,据此分析即可解答.
解答 解:A.FeCl3为盐,属于电解质,故A错误;
B.NH3气体只有分子,没有自由移动的离子,所以不导电,它的水溶液能导电是因为氨气和水反应生成的一水合氨电离出自由移动的阴阳离子,而不是氨气自身电离,所以为非电解质,故B正确;
C.NH4HCO3为盐,属于电解质,故C错误;
D.氯气为单质,既不是电解质也不是非电解质,故D错误,故选B.
点评 本题主要考查了非电解质概念的辨析,关键注意非电解质在熔融状态和水溶液中自身都不能离解出自由移动的离子,题目难度不大.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠能用作供氧剂 | |
| B. | 氯化钠可用作净水剂 | |
| C. | 味精可用作食品添加剂 | |
| D. | 小苏打是一种膨松剂,可用于制作馒头和面包 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下pH=7的CH3COOH与CH3COONa的混合液中离子浓度大小顺序为:c(Na+)>c(CH3COO-)>c(H+)=c(OH-) | |
| B. | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其1支加入少量MnO2,可以研究催化剂对H2O2分解速率的影响 | |
| C. | 热稳定性:HF>HC1>HBr>HI | |
| D. | 中和pH与体积均相同的盐酸和醋酸溶液消耗NaOH的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

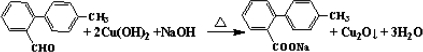 .
. 与
与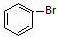 也可以发生类似反应①的反应,有机产物的结构简式为:
也可以发生类似反应①的反应,有机产物的结构简式为: .
.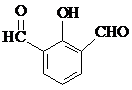 、
、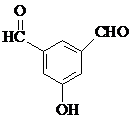 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大,其中只有W为第四周期元素.X与Y基态原子的成对电子数之比为2:3,未成对电子数之比为1:1,Z是元素周期表中s区元素,但有未成对电子,R的氢化物的沸点比其上周期同族元素氢化物的沸点低,W为金属元素,Y与W形成的某种化合物与R的氢化物的浓溶液加热时反应可用于实验室制取R的气态单质,回答下列问题:
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大,其中只有W为第四周期元素.X与Y基态原子的成对电子数之比为2:3,未成对电子数之比为1:1,Z是元素周期表中s区元素,但有未成对电子,R的氢化物的沸点比其上周期同族元素氢化物的沸点低,W为金属元素,Y与W形成的某种化合物与R的氢化物的浓溶液加热时反应可用于实验室制取R的气态单质,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KClO3(s)═2KCl(s)+3O2(g);△H=-78.03kJ•mol-1:△S=494.4 J•mol-1•K-1 | |
| B. | CO(g)═C(s,石墨)+$\frac{1}{2}$O2(g);△H=110.5kJ•mol-1,△S=-89.4 J•mol-1•K-1 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H=-444.3kJ•mol-1,△S=-280.1 J•mol-1•K-1 | |
| D. | NH4HCO3(s)+CH3COOH(aq)═CO2(g)+CH3COONH4(aq)+H2O(l);△H=37.30kJ•mol-1,△S=184.0 J•mol-1•K-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质的密度随着原子序数的增大而增大 | |
| B. | 碱金属单质都是银白色金属 | |
| C. | 在周期表中金属与非金属的分界处,可以找到半导体材料 | |
| D. | 所有气体单质都含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制氯化铁溶液时,先将氯化铁溶于较浓盐酸,再用蒸馏水稀释并加入少量铁粉 | |
| B. | 试管里加入少量淀粉,再加入一定量稀硫酸,加热3~4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现 | |
| C. | 氢氧化钠沾到皮肤上,先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗 | |
| D. | 为了减少实验误差,中和滴定用的锥形瓶必须洗净并烘干后使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com