

分析 由转化关系可知淡黄色固体为Na2O2,则A为CO2,B为O2,金属单质为Na,固体Y为Na2CO3,白色沉淀为CaCO3,结合对应物质的性质以及题目要求解答该题.
解答 解:由转化关系可知淡黄色固体为Na2O2,则A为CO2,B为O2,金属单质为Na,固体Y为Na2CO3,白色沉淀为CaCO3,
(1)由以上分析可知X为过氧化钠,A为CO2,故答案为:过氧化钠;CO2;
(2)①为Na2O2和CO2的反应,反应的方程式为2Na2O2+2CO2═2Na2CO3+O2,
②为Na2CO3和澄清石灰水的反应,反应的方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,
③为Na和O2的反应,反应的方程式为2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2,
④为碳酸钙和盐酸的反应,反应的方程式为CaCO3+2HCl═CaCl2+CO2↑+H2O,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2;CaCO3+2HCl═CaCl2+CO2↑+H2O.
点评 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力的考查,注意把握钠以及化合物的性质以及应用,本题以过氧化钠的颜色为解答该题的突破口,难度不大.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 18gD2O和18gH2O中含有的质子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1氯化钠溶液 | B. | 75 mL 1.5 mol•L-1氯化钾溶液 | ||
| C. | 150 mL 3 mol•L-1氯化钾溶液 | D. | 50 mL 3 mol•L-1氯化镁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +4 | B. | +5 | C. | +6 | D. | +7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
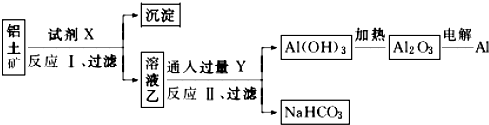
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na+、Ba2+、Cl-、NO3- | |
| B. | Pb2+、Hg2+、S2-、SO42- | |
| C. | 0.1mol/L的NaOH溶液中:K+、Na+、SO42-、CO32- | |
| D. | 0.1mol/L Na2CO3的溶液中:K+、Ba2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃,苯甲酸的熔点为121.7℃,沸点为249℃,溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水.制备苯甲醇和苯甲酸的主要过程如图1所示,试根据上述信息回答下列问题:
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃,苯甲酸的熔点为121.7℃,沸点为249℃,溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水.制备苯甲醇和苯甲酸的主要过程如图1所示,试根据上述信息回答下列问题:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com