
| A. | 1mol C6H14分子中共价键总数为20NA | |
| B. | 1mol乙基(-CH2CH3)电子总数17NA | |
| C. | 常温常压下,26g苯乙烯和苯组成的混合物中所含有的碳原子数为4NA | |
| D. | 标准状况下,22.4L甲醇的分子数中所含羟基数为NA |
分析 A、根据己烷分子含有的碳碳共价键和碳氢共价键数目计算出1mol己烷中含有的共价键数目;
B、乙基含有17个电子,计算分析;
C、苯乙烯和苯组成中碳氢原子个数比相等;
D、标况下,甲醇为液态;
解答 解:A、1mol己烷中含有5mol碳碳共价键和14mol碳氢共价键,总共含有19mol共价键,共价键总数为 19NA,故A错误;
B、乙基含有17个电子,1mol乙基(-CH2CH3)电子总数17 NA,故B正确;
C、苯乙烯和苯组成中碳氢原子个数比相等,最简式为CH,常温常压下,26g苯乙烯和苯组成的混合物中所含有的碳原子数为$\frac{26g}{13g/mol}$×NA=2NA,故C错误;
D、标况下,甲醇为液态,22.4L甲醇物质的量不是1mol,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是微粒数计算,气体摩尔体积的条件分析应用,掌握基础是关键,题目较简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | v(D)=0.40mol•L-1•s-1 | B. | v(C)=0.50mol•L-1•s_1 | ||
| C. | v(A)=0.30mol•L-1•s-1 | D. | v(B)=0.60mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
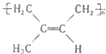 :其1mol单体跟1molBr2发生加成反应生成的产物有3种;
:其1mol单体跟1molBr2发生加成反应生成的产物有3种; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L | |
| B. | 标准状况下,4.0 g CH4中含有共价键的数目为NA | |
| C. | 1 mol C12发生化学反应,转移的电子数必为2NA | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 葡萄糖和果糖的分子式均为C6H12O6,二者互为同系物 | |
| D. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的颜色变浅 | |
| B. | 混合气体的密度不再变化 | |
| C. | 混合气体中NO2、NO、O2物质的量之比为2:2:1 | |
| D. | 单位时间内生成2n mol NO,同时生成2n mol NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C7H8O,且属于芳香族化合物的同分异构体只有4种 | |
| B. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物最多有6种 | |
| C. | 丙烷的一氯代物有2种,丙烷的二氯代物有4种 | |
| D. | 联苯(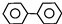 )的一氯代物有3种,二氯代物有12种 )的一氯代物有3种,二氯代物有12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | 镁浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②在盛有冷水的烧杯中滴入几滴酚酞溶液,再将一小块金属钠放入其中 | 有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | 剧烈反应,迅速产生大量无色气体 |
| ④将铝条投入稀盐酸中 | 反应不十分剧烈;产生无色气体 |
| ⑤向A1Cl3溶液中滴加NaOH溶液至过量 | 生成白色胶状沉淀,继而沉淀消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com