
【题目】下列说法正确的是( )
A.在纯水中加入盐一定促进水的电离
B.同温时,等浓度的NaHCO3和Na2CO3溶液,NaHCO3溶液的pH大
C.加热CH3COONa溶液,溶液中![]() 的值将变大
的值将变大
D.0.1mol·L-1HA弱酸溶液与0.05mol·L-1NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)=c(A-)+2c(OH-)
【答案】D
【解析】
A.在纯水中加入能够水解的盐才会促进水的电离,A选项错误;
B.同温度时,CO32-的水解程度大于HCO3-,因此Na2CO3溶液的碱性强,pH大,B选项错误;
C.加热CH3COONa溶液,CH3COO-的水解程度增大,c(CH3COO-)减小,c(Na+)不变,则![]() 的值减小,C选项错误;
的值减小,C选项错误;
D.0.1mol·L-1HA弱酸溶液与0.05mol·L-1NaOH溶液等体积混合,所得溶液为等浓度的NaA和HA的混合溶液,根据电荷守恒可以知道c(H+)+c(Na+)=c(A-)+c(OH-),根据物料守恒可以知道2c(Na+)=c(HA)+c(A-),两式联立可得2c(H+)+c(HA)=c(A-)+2c(OH-),D选项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】美国劳伦斯利弗莫尔国家实验室(LLNL)设计的以熔融的碳酸盐为电解质泡沫镍为电极、氧化纤维布为隔膜的直接碳燃料电池结构如图所示,下列说法错误的是( )
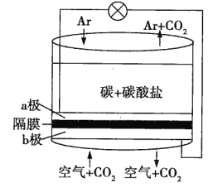
A.a极通Ar气的目的是增强导电能力
B.a极的电极反应式为C+2CO32--4e-=3CO2↑
C.电流由b极沿导线经负载再流向a极
D.CO32-由b极区透过隔膜流向a极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代永磁体材料——钕铁硼(NdFeB)因其优异的综合磁性能,被广泛应用于计算机、通信信息等高科技产业。
(1)铁、钴、镍元素性质非常相似,原子半径接近但依次减小,NiO、FeO的晶体结构类型与氯化钠相同。基态钴原子价电子轨道表示式为_______,熔沸点:NiO_____FeO(填“<”“>”或“=”)。
(2)FeSO4·(NH4)2SO4·6H2O俗称摩尔盐,相对于FeSO4·7H2O而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制Fe(Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是______________________。
(3)新型储氢材料氨硼烷(NH3BH3)常温下以固体稳定存在,极易溶于水。
①氨硼烷分子中B原子采取_________杂化。
②氨硼烷晶体中存在的作用力有范德华力、极性键、_______和_________。
(4)氨硼烷受热析氢的过程之一如图1所示。
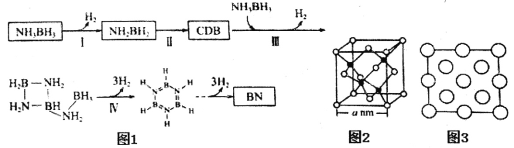
①NH2BH2的氮硼键键能大于NH3BH3,其原因为__________________________。
②CDB的结构简式为___________________________。
③立方氮化硼(BN)晶体的晶胞结构如图2所示。阿伏伽德罗常数值为NA,该晶体的密度为_______g·cm-3(用含a和NA的最简式表示)。图3是立方氮化硼晶胞的俯视投影图,请在图中用“●”标明B原子的相对位置_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学用语不正确的是
A. 闪锌矿(ZnS)经CuSO4溶液作用后,转化为铜蓝(CuS):ZnS + Cu2+ === CuS + Zn2+
B. 0.1 mol/L 的醋酸溶液pH约为3:CH3COOH ![]() CH3COO- + H+
CH3COO- + H+
C. 电解NaCl溶液,阴极区溶液pH增大:2H2O + 2e- === H2↑+ 2OH-
D. 钢铁发生吸氧腐蚀,负极反应为:Fe-3e- === Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】L-多巴是一种有机物,分子式为C9H11O4N,它可用于帕金森病的治疗,其结构简式为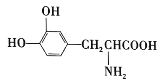 。下列关于L-多巴的叙述不正确的是( )
。下列关于L-多巴的叙述不正确的是( )
A.它属于α-氨基酸,既具有酸性,又具有碱性
B.它能与FeCl3溶液发生显色反应
C.它可以通过两分子间缩合形成分子式为C18H18O6N2的化合物,该化合物中有3个六元环
D.它既与酸反应又与碱反应,等物质的量的L-多巴最多消耗的NaOH与HC1的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用所学知识回答下列问题:
(1)常温下实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:___。
(2)晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s) ΔH=-989.2kJ·mol-1,有关键能数据如下表:
化学键 | Si—O | O=O | Si—Si |
键能/kJ·mol-1 | x | 498.8 | 176 |
已知1molSi中含2molSi—Si键,1molSiO2中含4molSi—O键,则x的值为__。
(3)AgNO3的水溶液呈___(填“酸”、“中”、“碱”)性,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,目的是___。
(4)在稀释醋酸的过程中,下列始终保持增大趋势的量是(______)
A.c(H+) B.H+个数 C.CH3COOH分子数 D.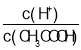
(5)某温度(t℃)时,水的离子积为Kw=1×10-13。若将此温度下pH=11的苛性钠溶液aL与pH=1的稀硫酸bL混合(设混合后溶液体积的微小变化忽略不计),若所得混合溶液的pH=2,则a∶b=__。
(6)已知Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应至少调至__。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应至少调至__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 X、Y、Z、W 原子序数依次增大,Y 与 W 同族。X、Y、Z 三种原子最外层电子数的关系 为 X+Z=Y。电解 Z 与 W 形成的化合物的水溶液,产生 W 元素的气体单质,此气体同冷烧碱溶液作 用,可得到化合物 ZWX 的溶液。下列说法正确的是
A.W 的氢化物稳定性强于 Y 的氢化物
B.Z与其他三种元素分别形成的化合物中只含有离子键
C.Z 与 Y 形成的化合物的水溶液呈碱性
D.对应的简单离子半径大小为 W >Z > X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是
A.钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机样品(仅含C、H、O三种元素)3.0g在足量O2中完全燃烧,将燃烧后的混合物先通过足量的浓硫酸,浓硫酸增重1.8g,再通过足量的澄清石灰水,经过滤得到10g沉淀。该有机样品的组成可能是(括号内给出的是有机物的分子式)( )
A.葡萄糖(C6H12O6)与蔗糖(C12H22O11)
B.醋酸与甲酸甲酯(C2H4O2)
C.乙醇与甲醛(CH2O)
D.二甲醚(C2H6O)与乳酸(C3H6O3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com