
 在下面的装置中,A是Cl2发生装置,C、D为气体的净化装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.试回答:
在下面的装置中,A是Cl2发生装置,C、D为气体的净化装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.试回答:分析 二氧化锰与浓盐酸在加热条件下生成氯气和氯化锰和水,浓盐酸易挥发制取的氯气中含有氯化氢和水,依据氯气和氯化氢的水溶性选择合适的除杂剂,浓硫酸具有吸水性,可以干燥氯气,干燥的氯气与铁反应生成氯化铁,氯气有毒,不能直接排放到空气,氯气能够与氢氧化钠反应生成氯化钠和次氯酸钠,可用氢氧化钠吸收过量的氯气,氯气氧化性强能够与铁反应生成氯化铁,据此解答.
解答 解:(1)实验制备氯气中含杂质气体氯化氢和水蒸气,氯化氢易溶于饱和氯化钠溶,而饱和氯化钠溶液中含有大量的氯离子,抑制氯气的溶解,通过饱和食盐水的C可以除去氯气中的氯化氢,浓硫酸具有吸水性,通过盛有浓硫酸的D可以除去氯气中的水蒸气,氯气有毒,能够与氢氧化钠溶液反应,可用氢氧化钠吸收过量的氯气;
故答案为:饱和食盐水;除去Cl2中的HCl杂质;浓硫酸;干燥Cl2;NaOH溶液;
(2)装置气密性检查方法向C中加水至没过长导管,关闭分液漏斗活塞,微热烧瓶,导管口处有气泡,停止加热,导管会有一段水柱,则气密性良好;
故答案为:向C中加水至没过长导管,关闭分液漏斗活塞,微热烧瓶,导管口处有气泡,停止加热,导管会有一段水柱,则气密性良好;
(3)铁与氯气反应生成氯化铁,氯化铁为棕色固体,所以看到现象:产生棕色烟;
故答案为:棕色烟;FeCl3;
(4)A中二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
G中氯气与氢氧化钠溶液反应生成氯化钠和次氯酸钠和水,方程式:Cl2+2OH-=Cl-+ClO-+H2O;
铁与氯气反应生成氯化铁,方程式:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;Cl2+2OH-=Cl-+ClO-+H2O;2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
点评 本题考查了氯气的制备和性质的检验,明确氯气制备原理和化学性质是解题关键,注意装置气密性检验方法,题目难度不大.


 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 该有机物不存在 | B. | 该有机物的分子式为C4H4 | ||
| C. | 该有机物的空间构型为正四面体 | D. | 该有机物不属于笨的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当v(H2)=v(H2O)时,达到平衡 | |
| B. | 升高温度,正反应速率减小,逆反应速率增大,化学平衡逆向移动 | |
| C. | 使用高效催化剂可提高NO的平衡转化率 | |
| D. | 化学平衡常数表达式为K=$\frac{c({N}_{2})•{c}^{4}({H}_{2}O)}{c(S{O}_{2})•{c}^{2}(NO)•{c}^{4}({H}_{2})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
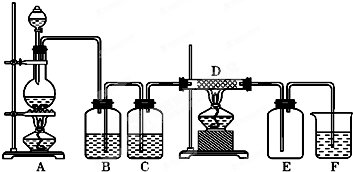 如图所示,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置.
如图所示,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
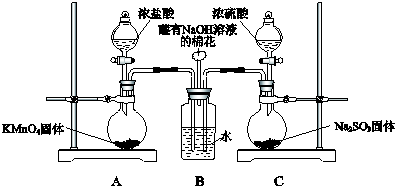
 某校化学实验兴趣小组为了探究实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),完成下列问题.
某校化学实验兴趣小组为了探究实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),完成下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示的装置为铁的吸氧腐蚀实验.一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,可观察到现象为铁钉附近的溶液有蓝色沉淀,该反应的离子方程式为Fe2++[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓; 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为O2+4e-+2H2O=4OH.
如图所示的装置为铁的吸氧腐蚀实验.一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,可观察到现象为铁钉附近的溶液有蓝色沉淀,该反应的离子方程式为Fe2++[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓; 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为O2+4e-+2H2O=4OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
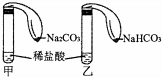 为对比Na2CO3与NaHCO3的性质,实验小组的同学们在甲、乙两支试管中分别加入足量稀盐酸,将两个分别装有Na2CO3或NaHCO3粉末的小气球分别套在两支试管口.将气球内的Na2CO3或NaHCO3倒入试管中(如图).
为对比Na2CO3与NaHCO3的性质,实验小组的同学们在甲、乙两支试管中分别加入足量稀盐酸,将两个分别装有Na2CO3或NaHCO3粉末的小气球分别套在两支试管口.将气球内的Na2CO3或NaHCO3倒入试管中(如图).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com