
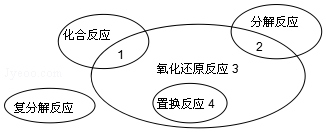
 25℃时,已知AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是( )
25℃时,已知AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是( )| A. | Ag2CO3的Ksp为8.1×10-12 | |
| B. | Ag2CO3(s)+2Cl-(aq)?2AgCl(s)+CO32-(aq)平衡常数K=2.5×108 | |
| C. | 在Ag2CO3的饱和溶液中加入K2CO3(s)可使c(CO32-)增大(由Y点到Z点) | |
| D. | 在0.001mol•L-1AgNO3溶液中滴入同浓度的KCl和K2CO3的混合溶液,CO32-先沉淀 |
分析 A.Ag2CO3的Ksp=c2(Ag+)c(CO32-);
B.Ag2CO3(s)+2Cl-(aq)?2AgCl(s)+CO32-(aq)平衡常数K=$\frac{c(C{O}_{3}{{\;}^{2-})}^{\;}}{{c}^{2}(C{l}^{-})}$=$\frac{Ksp(A{g}_{2}C{O}_{3})}{Ksp(AgCl)×Ksp(AgCl)}$;
C.Ag2CO3的饱和溶液中加入K2CO3(s),c(CO32-)增大,溶解平衡逆向移动;
D.结合Ksp及银离子浓度计算阴离子浓度,阴离子浓度小的先沉淀.
解答 解:A.Ag2CO3的Ksp=c2(Ag+)c(CO32-)=(9×10-4)2×10-5=8.1×10-12,故A正确;
B.Ag2CO3(s)+2Cl-(aq)?2AgCl(s)+CO32-(aq)平衡常数K=$\frac{c(C{O}_{3}{{\;}^{2-})}^{\;}}{{c}^{2}(C{l}^{-})}$=$\frac{Ksp(A{g}_{2}C{O}_{3})}{Ksp(AgCl)×Ksp(AgCl)}$=$\frac{8.1×1{0}^{-12}}{(1.8×1{0}^{-10})^{2}}$=2.5×108,故B正确;
C.Ag2CO3的饱和溶液中加入K2CO3(s),c(CO32-)增大,溶解平衡逆向移动,c(Ag+)减小,可使溶液由Y点到Z点,故C正确;
D.c(Cl-)=$\frac{1.8×1{0}^{-10}}{0.001}$=1.8×10-7mol/L,c(CO32-)=$\frac{8.1×1{0}^{-12}}{(0.001)^{2}}$=8.1×10-6mol/L,则Cl-先沉淀,故D错误;
故选D.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp的计算、溶解平衡移动、平衡常数计算为解答的关键,侧重分析与计算能力的考查,注意K的计算,题目难度不大.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2H+=Ca2++CO2↑+H2O | B. | 2Fe2++Cl2=2Fe3++2Cl- | ||
| C. | HCO3-+H+=CO2↑+H2O | D. | H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2K2O2+2CO2═2K2CO3+O2 | B. | Cl2+2KBr═Br2+2KCl | ||
| C. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | D. | 2NaHCO3═Na2CO3+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量Cl-的溶液中肯定不存在Ag+ | |
| B. | AgI悬浊液中加入少量KI粉末,平衡AgI(s)?Ag+(aq)+I-(aq)向左移动,溶液中离子的总浓度会减小 | |
| C. | AgCl悬浊液中逐渐加入KI固体至c(I-)=$\frac{{K}_{sp}(AgI)}{{K}_{sp}(AgCl)}$mol•L-1时,AgCl开始向AgI沉淀转化 | |
| D. | 向浓度均为0.01 mol•L-1的KCl和KI的混合溶液中滴加AgNO3溶液,当Cl-开始沉淀时,溶液中I-的浓度为1.25×10-8 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
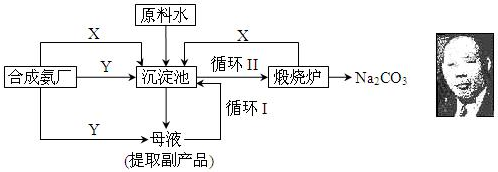
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度时,两种饱和溶液中:c(Cl-)≈1.9c(Br-) | |
| B. | AgCl、AgBr组成的混合溶液中:c(Cl-)>c(Br-) | |
| C. | 向饱和AgCl溶液中通入HCl后有沉淀生成,但溶液中c(Cl-)增大 | |
| D. | AgBr在水中溶解度及Ksp均比在NaBr溶液中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
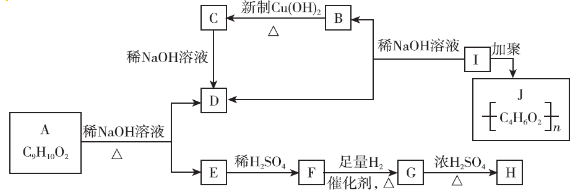
 .
.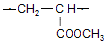 .
.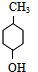 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$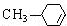 +H2O.
+H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
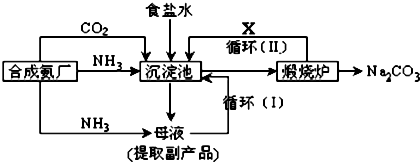
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量12.8gCuSO4溶解在100mL水中 | |
| B. | 称量25.0gCuSO4•5H2O晶体溶于100mL水中 | |
| C. | 称量16.0gCuSO4溶于水,然后稀释至100mL | |
| D. | 称量20.0gCuSO4•5H2O晶体溶于水,然后稀释至100mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com