
【题目】按要求填空:
(1)0.4 mol OH-的质量为 ,其中含有 个电子。
(2)质量比为16:7:6的三种气体SO2、CO、NO氧原子个数之比为 ;同条件下体积比为 。
(3)标准状况下,1体积水能溶解448体积HCI,所得溶液的密度为1.1 g/mL,该溶液的质量分数和物质的量的浓度分别是 、 。(保留1位小数)
【答案】(1)6.8g;2.408×1024 ;(2)10:5:4 ;5:5:4;(3)42.2%,12.7mol·L-1 。
【解析】
试题分析:(1)根据公式m=M·n,因此0.4 mol OH-的质量为:m=17g·mol-1×0.4mol=6.8g ;1个OH-中含有的电子数为10个,则0.4 mol OH-中含有的电子数为:10×0.4mol×6.02×1023 mol-1=2.408×1024 ;(2)由于n=m/M,因此质量比为16:7:6的三种气体SO2、CO、NO的物质的量之比为:![]() ,则三种气体所含氧原子的物质的量之比为:5×2:5:4=10:5:4,故三种气体所含氧原子的个数之比为10:5:4 ;根据理想气体状态方程pV=nRT可知,同条件下,体积之比等于物质的量之比,故同条件下三种气体的体积之比为:5:5:4 ;(3)标准状况下,假设溶剂水的体积是1L,则溶质HCl的体积是448L,故HCl的物质的量为:
,则三种气体所含氧原子的物质的量之比为:5×2:5:4=10:5:4,故三种气体所含氧原子的个数之比为10:5:4 ;根据理想气体状态方程pV=nRT可知,同条件下,体积之比等于物质的量之比,故同条件下三种气体的体积之比为:5:5:4 ;(3)标准状况下,假设溶剂水的体积是1L,则溶质HCl的体积是448L,故HCl的物质的量为:![]() ,HCl的质量为:m(HCl)=20mol×36.5 g·mol-1=730g,水的密度为1g·mL-1,则溶剂的质量为m(H2O)=1000 cm3×1g·mL-1=1000g;故溶质的质量分数为:
,HCl的质量为:m(HCl)=20mol×36.5 g·mol-1=730g,水的密度为1g·mL-1,则溶剂的质量为m(H2O)=1000 cm3×1g·mL-1=1000g;故溶质的质量分数为:![]() ;由于所得溶液的密度为1.1 g/mL,因此溶液的总体积
;由于所得溶液的密度为1.1 g/mL,因此溶液的总体积![]() ,故所得溶液的物质的量浓度c(HCl)=20mol/1.57L=12.7mol ·L-1。
,故所得溶液的物质的量浓度c(HCl)=20mol/1.57L=12.7mol ·L-1。


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】相同体积,相同pH的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )
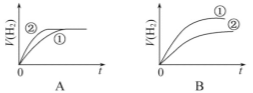
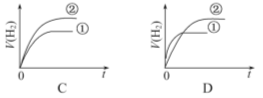
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化合物的叙述不正确的
A. 纤维素是植物细胞壁的主要成分,它的单体(基本组成单位)是葡萄糖
B. 蛋白质是生命活动的主要承担者,它的单体是氨基酸
C. DNA是具细胞结构生物的遗传物质,它的单体是脱氧核苷酸
D. 磷脂是细胞膜的主要成分,只含有C、H、0三种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中,属于微量元素的是
A. C、H、N、P、Mn B. Cl、Fe、S、N、Mg
C. B、Cu、Zn、Mn、Mo D. N、P、K、Cu、Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一支25 mL的酸式滴定管中加入0.1 mol/L的HCl溶液,其液面恰好在5 mL刻度处,若把滴定管中的溶液全部放入烧杯中,然后用0.1 mol/L的NaOH溶液进行中和,则所需NaOH溶液的体积( )
A. 等于5 mL B. 大于20 mL C. 等于20 mL D. 小于20 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示①、②两个装置的叙述中,正确的是( )

A.硫酸浓度变化:①增大,②减小
B.装置名称:①是原电池,②是电解池
C.电极反应式:①中阳极:4OH--4e-=2H2O+O2↑;②中正极:Zn-2e-===Zn2+
D.离子移动方向:①中H+向阴极方向移动,②中H+向负极方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)如图为C及其氧化物的变化关系图,若①是通过O2与C反应实现的,测知生成14gCO时放出60kJ的热量,则其热化学方程式为 。

(2)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) △H3<0 ③
2H2(g)+O2(g)=2H2O(g) △H4<0 ④
则途径I放出的热量 (填“大于”“等于”或“小于”)途径II放出的热量;△H1、△H2、△H3、△H4的数学关系式是 。
(3)甲醇(CH3OH)是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
方法二 CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
在25℃、101kPa下,1 克液态甲醇完全燃料放热25kJ,写出甲醇燃烧生成1molCO2的热化学方程式 。若将该反应设计成原电池反应,用稀H2SO4 作电解质,则其电极方程式分别为正极: 负极:
(4)金属钛冶炼过程中其中一步反应是将原料金红石转化:
TiO2(金红石)+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
已知:C(s)+O2(g)=CO2(g) △H= - 400kJ·mol―1
2CO(g)+O2(g)=2CO2(g) △H= - 560kJ·mol―1
TiO2(s)+2Cl2(g)=TiCl(s)+O2(g) △H=+140kJ·mol―1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= 。
(5)臭氧可用于净化空气、饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s) △H=―260kJ·mol―1
已知:2Ag2O(s)=4Ag(s)+O2(g) △H=+70kJ·mol―1
则O3转化为O2的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于晶体的下列说法正确的是( )
A. 在晶体中只要有阴离子就一定有阳离子
B. 在晶体中只要有阳离子就一定有阴离子
C. 金属能导电是因为金属晶体中的自由电子在外加电场作用下可发生定向移动
D. 分子晶体的熔点一定比金属晶体的低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对乙烯和聚乙烯的描述中,不正确的是( )
A.乙烯是纯净物,聚乙烯是混合物
B.常温下,乙烯为气态,聚乙烯为固态
C.乙烯的化学性质与聚乙烯相同
D.取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com