
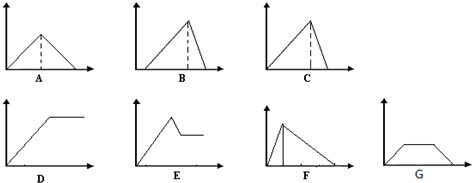
| A. | 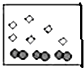 | B. | 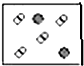 | C. |  | D. | 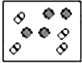 |
分析 如图表示氦分子与氢气分子的数量关系,分子数之比等于该物质的物质的量之比,根据n=$\frac{m}{M}$判断等质量的氢气与氦气的物质的量之比,注意稀有气体是单原子分子.
解答 解:氦气的摩尔质量为4g/mol.氢气的摩尔质量为2g/mol,
设质量为4g,则氦气的物质的量为:$\frac{4g}{4g/mol}$=1mol,
氢气的物质的量为:$\frac{4g}{2g/mol}$=2mol,
所以氢气分子与氦气分子的分子数之比为:2mol:1mol=2:1,
稀有气体为单原子分子,故A、C错误;
B中氢气与氦气的物质的量之比为2:1,D中为1:1,故B正确、D错误;
故选B.
点评 本题考查学生对信息的提取以及阿伏伽德罗定律的利用,题目难度不大,明确气体为单原子为分子为解答关键,注意掌握阿伏伽德罗定律及其推论的内容.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题
 ,C和E形成化合物的电子式
,C和E形成化合物的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液一定存在NH4+、I- | |
| B. | 原溶液一定不含Ba2+、Fe3+、I- | |
| C. | 原溶液可能存在K+、Fe3+、SO42- | |
| D. | 另取试液滴加足量盐酸、BaCl2溶液,即可确定溶液所有的离子组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
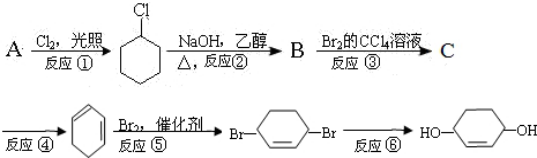
 .
.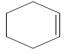 +Br2→
+Br2→ .
.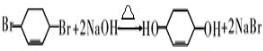 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
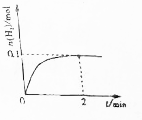 一定温度下,向2L密闭容器中加入1molNH3(g).发生反应2NH3(g)?3H2(g)+N2(g)△H=+92kJ/mol
一定温度下,向2L密闭容器中加入1molNH3(g).发生反应2NH3(g)?3H2(g)+N2(g)△H=+92kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、复合材料等高新材料领域.
硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、复合材料等高新材料领域.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 足量硫酸铝与纯碱反应:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ | |
| C. | 氯气与水反应:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 向Ba(OH)2溶液中加入少量NaHSO3溶液:2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com