
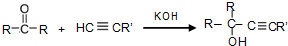
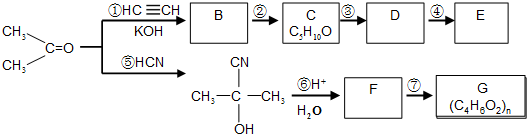
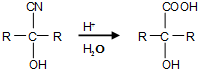
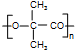
 ,据此答题.
,据此答题. ,
,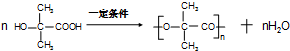 ,
,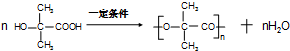 .
.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水,然后将所得溶液分别置于A、B试管中. | 固体物质全部完全溶解 |
| 步骤2:向A试管中滴加适量BaCl2溶液. | a.如果 b.如果 |
| 步骤3: | 有白色沉淀生成,C的成分有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏法是除去水中杂质得到纯净的水的最好方法 |
| B、用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
| C、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| D、用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 尿黑酸症是由酪氨酸在人体内非正常代谢而产生的一种疾病.酪氨酸结构简式如图所示,下列关于酪氨酸的说法不正确的是( )
尿黑酸症是由酪氨酸在人体内非正常代谢而产生的一种疾病.酪氨酸结构简式如图所示,下列关于酪氨酸的说法不正确的是( )| A、酪氨酸的分子式为C9HllNO3 |
| B、酪氨酸能发生缩聚反应生成高分子化合物 |
| C、酪氨酸能与溴水发生取代反应 |
| D、1mol酪氨酸能和2 molNaHCO3反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 气体 | CO2 | H2 | CO | H2O |
| 浓度(mol/L) | 0.1 | 0.9 | 0.3 | 0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 碳及其化合物应用广泛.
碳及其化合物应用广泛.| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO)/mol | 0.200 | 0.160 | 0.125 | 0.099 | 0.080 | 0.080 |
| n(H2O)/mol | 0.300 | 0.260 | 0.225 | 0.199 | 0.180 | 0.180 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com