
已知:N2O4(g)  2NO2(g) ΔH=+57.20kJ · mol-1
2NO2(g) ΔH=+57.20kJ · mol-1
在100℃时,将0.100molN2O4气体充入1L恒容抽空的密闭容器中,每隔一定时间对该容器内的物质浓度进行分析得到下表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
c(N2O4) /mol··L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
c(NO2) /mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
(1) 该反应的平衡常数表达式为 ______;从表中数据分析:
c1 c2 (填“>” 、“<” 或“=” )。
(2)下列叙述能证明该反应已达到化学平衡状态的是
A.容器内压强不再发生变化
B.NO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗n mol N2O4的同时生成2n mol NO2
E.反应体系中NO2、N2O4的体积比为1:2
(3)若起始时充入NO2气体0.200mol,则达到平衡时NO2气体的转化率为a;其它条件不变时,下列措施能提高NO2转化率的是 (填字母)。
A.降低温度
B.减小NO2的浓度
C.升高温度
D.增加NO2的浓度
E.再充入一定量的He
(1)k=9  (2) AB (3) AD
(2) AB (3) AD
【解析】
试题分析:由表框可知c(NO2)=0.120 mol·L-1时反应达到平衡的状态。则此时消耗了四氧化二氮0.6 mol·L-1所以在平衡状态下它的浓度为1-0.6=0.4 mol·L-1所以答案为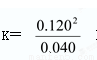 当反应前后的气体化学计量数总和不同时,可从压强去判断是否达到了平衡的状态。B选项其实就是浓度保持不变,所以答案为A、B而C选项不管在什么时候容器内气体原子总数不再发生变化而D选项应为相同时间内消耗n mol N2O4的同时消耗2n mol NO2、E选项不用用来判断是否达到平衡。(3)该反应是吸热反应,所以降低温度反应向逆反应方向移动。所以A可选增大二氧化氮的浓度反应向逆反应方向移动,所以D可选
当反应前后的气体化学计量数总和不同时,可从压强去判断是否达到了平衡的状态。B选项其实就是浓度保持不变,所以答案为A、B而C选项不管在什么时候容器内气体原子总数不再发生变化而D选项应为相同时间内消耗n mol N2O4的同时消耗2n mol NO2、E选项不用用来判断是否达到平衡。(3)该反应是吸热反应,所以降低温度反应向逆反应方向移动。所以A可选增大二氧化氮的浓度反应向逆反应方向移动,所以D可选
考点:化学反应速率与化学平衡的相关知识点


科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
常温下,将VL0.10mol·L-1盐酸和VL0.06mol·L-1Ba(OH)2溶液混合后,该混合液的pH为(设混合后总体积为2VL)
A.1.7 B.12.3 C.12 D.2
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省四地六校高三高考模拟试理综化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A. 服用铬含量超标的药用胶囊会对人对健康造成危害
B. 食用一定量的油脂能促进人体对某些维生素的吸收
C.CH4和Cl2在光照条件下反应的产物最多可能有四种
D.无论乙烯的加成,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有碳碳双键有关
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省南平市毕业班质量检查理综化学试卷(解析版) 题型:简答题
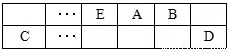
(15分)A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀或损坏。请回答下列问题:
(1)A元素的氢化物水溶液能使酚酞变红的原因用电离方程式解释为 。
(2)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a b(填“>"或“<”或“=”)
(3)常温下,相同浓度F、G简单离子的溶液中滴加NaOH溶液,F、G两元素先后沉淀,F (OH)n完全沉淀的pH是4.7,G (OH)n完全沉淀的pH是2.8,则ksp较大的是: (填化学式)
(4)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有: 。
①酸雨 ②温室效应③光化学烟雾 ④臭氧层破坏
(5)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 。
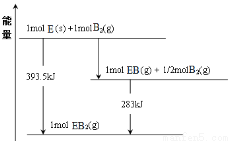
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如下左图所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式 。
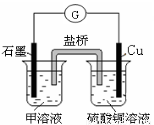
(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如上右图所示,其反应中正极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省南平市毕业班质量检查理综化学试卷(解析版) 题型:选择题
化学与生产、生活、社会密切相关。下列说法中不正确的是( )
A.“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致。
B.绿色化学的核心是从源头上消除工业生产对环境的污染。
C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈。
D.华商科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是
A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH-= Mg(OH)2↓+ 2CaCO3↓+ 2H2O
B.Cu2+ + H2S = CuS↓+ 2H+
C.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑
D.FeS + 2H+ = Fe2+ + H2S↑
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
已知2A(g) 2B(g)+C(g)ΔH<0,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是
2B(g)+C(g)ΔH<0,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是
A.升温 B.增大反应器的体积 C.增大c(A) D.降温
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列除去杂质(括号内物质为少量杂质)的方法中,正确的是( )
A.乙烷(乙烯):光照条件下通入Cl2,气液分离
B.乙酸乙酯(乙酸):用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏
C.CO2(SO2):气体通过盛氢氧化钠溶液的洗气瓶
D.乙醇(乙酸):加足量浓硫酸,蒸馏
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:选择题
X、Y、Z是短周期的三种主族元素,在周期表中的相对位置如图所示,下列说法正确的是
X | |
Y | Z |
A.原子半径:X<Y<Z
B.X、Y、Z三种元素的最高价氧化物对应水化物中最多有一种强酸
C.X的气态氢化物的稳定性比Y的气态氢化物强
D.常温下X、Y、Z的单质不可能均与盐酸反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com