
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| C. | 侯氏制碱法的最终产品是小苏打 | |
| D. | 明矾可用于水的杀菌、消毒 |
分析 A.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染;
B.维生素C具有还原性,能与氧化剂反应;
C.侯氏制碱法是制备纯碱;
D.明矾没有强氧化性,不能杀菌消毒.
解答 解:A.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染,故A错误;
B.维生素C具有还原性,能与氧化剂反应,所以维生素C在人体内起抗氧化作用,故B正确;
C.侯氏制碱法是制备纯碱,侯氏制碱法的过程中生成小苏打,小苏打再受热分解生成纯碱,故C错误;
D.明矾没有强氧化性,不能杀菌消毒,明矾在水中电离出铝离子,铝离子水解生成氢氧化铝胶体,能吸附净水,故D错误.
故选B.
点评 本题考查了化学知识在生产生活中的应用,题目难度不大,熟悉物质的性质是解题关键,平时要注意多积累,做题时要积极联想和所学知识联系起来.


科目:高中化学 来源: 题型:解答题
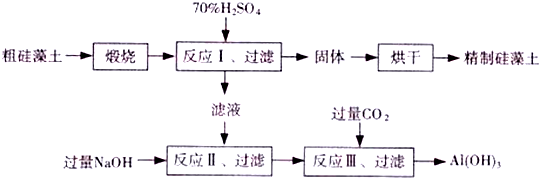
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
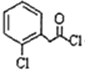
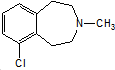 )一种治疗心血管和高血压的药物,可由化合物B(
)一种治疗心血管和高血压的药物,可由化合物B( )通过以下路线合成:
)通过以下路线合成: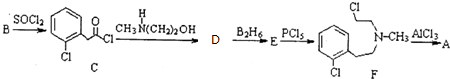
 +CH3NH(CH2)2OH→
+CH3NH(CH2)2OH→ +HCl.
+HCl. .由F生成A的反应类型为取代反应.
.由F生成A的反应类型为取代反应. 或
或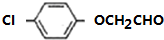 .
.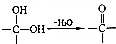 .写出以
.写出以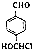 为原料制备化合物
为原料制备化合物 的合成路线流程图.
的合成路线流程图. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
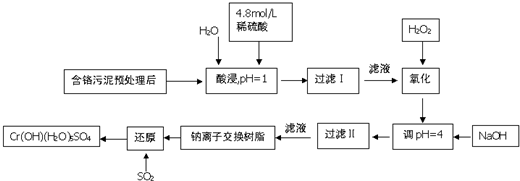
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | - | - | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①②③均属于氧化还原反应 | B. | H2和HCl均可循环利用 | ||
| C. | SiO2是一种坚硬难熔的固体 | D. | 硅可用于制作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 小苏打溶液中滴加足量澄清石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | Fe3O4溶于足量的稀盐酸:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| C. | 将少量的SO2气体通入NaClO溶液中:SO2+H2O+ClO-═SO42-+Cl-+2H+ | |
| D. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+═BaSO4↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
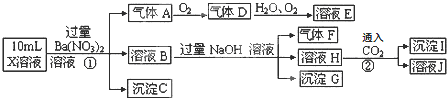
| A. | 气体F不能与溶液E发生反应 | |
| B. | X中肯定存在Fe2+、Al3+、NH4+、SO42- | |
| C. | X中肯定不存在CO32-、SO32-、Cl- | |
| D. | X中不能确定的离子是Al3+和Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
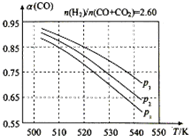 甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:| 物质 | CO | CO2 | H2 | CH3OH(g) |
| 标准生成热(kJ/mol) | -110.52 | -393.51 | 0 | -201.25 |
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
| CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
| a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
| b | 387 | 0.40 | 0 | 0 | ||
| c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com