
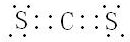 .
.分析 X、Y、Z、W、Q为前四周期的五种元素,且原子序数依次增大,X、Y、Z、W均为非金属元素,W可以形成W2-离子,处于VIA族,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,则Q处于第三周期,XW2分子与Y3-为等电子体,元素W和元素Z为同族元素,X为C元素、Y为N元素、Z为O元素、W为S元素,Q原子次外层电子数为5+8=13,外围电子排布式为3d54s2,则Q为Mn元素.
解答 解:X、Y、Z、W、Q为前四周期的五种元素,且原子序数依次增大,X、Y、Z、W均为非金属元素,W可以形成W2-离子,处于VIA族,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,则Q处于第三周期,XW2分子与Y3-为等电子体,元素W和元素Z为同族元素,X为C元素、Y为N元素、Z为O元素、W为S元素,Q原子次外层电子数为5+8=13,外围电子排布式为3d54s2,则Q为Mn元素.
(1)同周期自左而右电负性增大,同主族自上而下电负性减小,非金属性越强电负性越大,故上述五种元素中氧元素的电负性最大,N原子最外层2p轨道半充满,能量低,所以稳定,第一电离能大于氧元素等,
故答案为:O;N原子最外层2p轨道半充满,能量低,所以稳定;
(2)CS2的电子式为: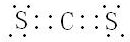 ,故答案为:
,故答案为: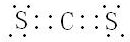 ;
;
(3)Q的价电子排布式为3d54s2,N3-与CO2互为等电子体,二者结构相似,N3-为直线形结构,故答案为:3d54s2;直线形;
(4)a.SO2中S原子孤电子对数=$\frac{6-2×2}{2}$=1、价层电子对数=2+1=3,为V形结构,属于极性分子,SO2中S原子杂化轨道数目为3,采取sp2杂化,
故选:d;
(5)W有两种常见的含氧酸,S的正电性越高,导致S-O-H中O的电子向S偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强,
故答案为:强;S的正电性越高,导致S-O-H中O的电子向S偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强;
(6)α-MnS的晶胞是立方体,用X射线衍射法测得该晶体晶胞边长=520.0pm,26℃测得该晶体的密度为4.1g/cm3,晶胞质量为4.1g/cm3×(520×10-10cm)3,设晶胞中Q、W离子数目为y,则y×$\frac{87}{6.02×1{0}^{23}}$g=4.1g/cm3×(520×10-10cm)3,解得y=4,
答:一个晶胞中含有的Q、W离子数均为4.
点评 本题是对物质结构与性质的考查,推断元素是解题关键,注意根据离子电荷、等电子体进行推断,掌握均摊法进行晶胞有关计算.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-的水解程度大于电离程度 | B. | HCO3-的水解程度小于电离程度 | ||
| C. | HCO3-的水解程度等于电离程度 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,阳极质量减少6.4g,电路中电子转移的总数为0.2NA | |
| B. | 6.0gSiO2晶体中含有0.2NA个Si-O键 | |
| C. | NA个CH4在标准状况下的体积约为22.4L | |
| D. | 苯与液溴反应生成1mol 时消耗0.5NA个Br2 时消耗0.5NA个Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
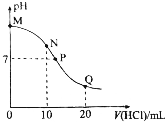 已知连二次硝酸(H2N2O2)是一种二元酸,25℃时,用0.01mol.L-1的盐酸滴定10mL0.01mol.L-1Na2N2O2溶液,溶液的pH与盐酸体积[V(HCl)]的关系如图所示.下法说法正确的是( )
已知连二次硝酸(H2N2O2)是一种二元酸,25℃时,用0.01mol.L-1的盐酸滴定10mL0.01mol.L-1Na2N2O2溶液,溶液的pH与盐酸体积[V(HCl)]的关系如图所示.下法说法正确的是( )| A. | M点的溶液中加人少量水,溶液的pH增大 | |
| B. | N点溶液中:c(N2O22-)+c(OH-)>c(H2N2O2) | |
| C. | P点溶液中,H2O不发生电离 | |
| D. | 溶液中$\frac{c({H}^{+})}{c(H{N}_{2}{{O}_{2}}^{-})}$:N>P>Q. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | 水分子的比例模型: | ||
| C. | 硅的原子结构示意图: | D. | Na2S的电子式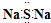 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com